-
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10﹣5 | Ka=2.98×10﹣8 | Ka1=4.3×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
下列离子方程式正确的是( )
A.少量的CO2通入NaClO溶液中:CO2+H2O+2ClO﹣═CO32﹣+2HClO
B.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32﹣═SO32﹣+2HCO3﹣
C.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO
D.相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3﹣═CO2↑+2H2O
-
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
| 醋酸 | 碳酸 | 亚硫酸 |
| Ka= 1.75×10-5 | Ka1= 4.30×10-7 Ka2 = 5.61×10-11 | Ka1= 1.54×10-2 Ka2 = 1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式Ka2= 。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱 > > 。
(3)下图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
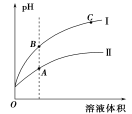
①图像中,曲线I表示的酸是 (填化学式)。
②A、B、C三点中,水的电离程度最大的是 (填字母)。
-
(8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
| 醋酸 | 碳酸 | 亚硫酸 |
| Ka= 1.75×10-5 | Ka1= 4.30×10-7 Ka2 = 5.61×10-11 | Ka1= 1.54×10-2 Ka2 = 1.02×10-7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = 。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > > 。
(3)下图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化
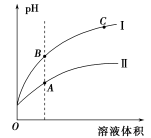
①图像中,曲线I表示的酸是 (填化学式)。
②A、B、C三点中,水的电离程度最大的是 (填字母)。
-
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1=__.
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:__>__>__.
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化图象中:
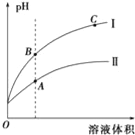
①曲线I表示的酸是__(填化学式).
②A、B、C三点中,水的电离程度最大的是__(填字母).
(4)下列事实不能说明醋酸是弱酸的是_______
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水多
-
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1=__.
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:__>__>__.
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化图象中:
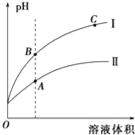
①曲线I表示的酸是__(填化学式).
②A、B、C三点中,水的电离程度最大的是__(填字母).
(4)下列事实不能说明醋酸是弱酸的是_______
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水多
-
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7
Ka2=5.61×10-11 | Ka1=1.54×10-2
Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO =SO
=SO +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
-
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | K a=1.75×10-5 | K a=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A. 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3
B. 将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C. 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D. 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
-
(8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ka= 1.75×10-5
碳酸 Ka1= 4.30×10-7 Ka2 = 5.61×10-11
亚硫酸 Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ________ ;
碳酸的第一步电离比第二步电离________(填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:________ >________>________
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是________(填序号)
A.c(CH3COO-) B.c(H+) C.醋酸的电离平衡常数 D.醋酸的电离度
-
已知部分弱酸的电离平衡常数如表:
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO +2HClO
+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO ═SO
═SO +2HCO
+2HCO
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO ═CO2↑+H2O
═CO2↑+H2O
-
已知部分弱酸的电离平衡常数如表所示:
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25 ℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O



