-
为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
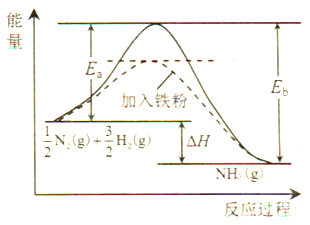
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
| 化学键 | H-H | N≡N | N-H |
| E/(kJ/mol) | 436 | 946 | 391 |
反应 N2(g) +
N2(g) + H2(g)
H2(g)  NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
 N2(g) +
N2(g) + H2(g) 的活化能Eb=______kJ/mol。
H2(g) 的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g) +O2(g)  2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO) =0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v 逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为: CO(g) +2H2(g) CH3OH(g)。若在一容积可变的密闭容器中充入1mol CO和2mol H2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T) 的变化如右图中曲线所示。
CH3OH(g)。若在一容积可变的密闭容器中充入1mol CO和2mol H2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T) 的变化如右图中曲线所示。

①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB (填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。
-
氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。 合成氨反应中有关化学键键能数据如下表:
| 化学键 | H—H | N≡N | N—H |
| E/ kJ•mol﹣1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g) 2NH3(g)的活化能Ea=508 kJ•mol﹣1,则氨分解反应:2NH3(g)
2NH3(g)的活化能Ea=508 kJ•mol﹣1,则氨分解反应:2NH3(g) N2(g)+3H2(g)的活化能Ea=_____。
N2(g)+3H2(g)的活化能Ea=_____。
②下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。

③依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_______________。
(2)选择性催化还原脱硝技术(SCr)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCr脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。

②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
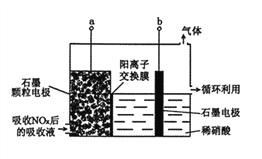
③直接电解吸收也被用于脱硝。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。阳极的电极反应式为_____。

-
氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。 合成氨反应中有关化学键键能数据如下表:
| 化学键 | H—H | N≡N | N—H |
| E/ kJ•mol﹣1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g) 2NH3(g)的活化能Ea=508 kJ•mol﹣1,则氨分解反应:2NH3(g)
2NH3(g)的活化能Ea=508 kJ•mol﹣1,则氨分解反应:2NH3(g) N2(g)+3H2(g)的活化能Ea=_____。
N2(g)+3H2(g)的活化能Ea=_____。
②下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。

③依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_______________。

(2)选择性催化还原脱硝技术(SCr)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCr脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。

②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
③直接电解吸收也被用于脱硝。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。阳极的电极反应式为_____。
-
氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。合成氨反应中有关化学键键能数据如下表:
| 化学键 | H—H | N≡N | N—H |
| E/kJ•mol-1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g) 2NH3(g)的活化能Ea=508kJ•mol-1,则氨分解反应:NH3(g)
2NH3(g)的活化能Ea=508kJ•mol-1,则氨分解反应:NH3(g)
 N2(g)+
N2(g)+ H2(g)的活化能Ea=_____。
H2(g)的活化能Ea=_____。
②图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据如图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。

③依据温度对合成氨反应的影响,在如图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_____。

(2)选择性催化还原脱硝技术(SCR)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCR脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H=-1625.5kJ•mol-1;氨氮比
4N2(g)+6H2O(g) △H=-1625.5kJ•mol-1;氨氮比 会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当
会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当 >1.0时,烟气中NO浓度反而增大,主要原因是_____。
>1.0时,烟气中NO浓度反而增大,主要原因是_____。

②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
-
(1 6分)随着科学技术的进步,硫及其化合物的研究越来越深人。
(1)共生工程可以促进化学工业的发展,并改善环境。
①下列有关环境问题的说法错误的是________(填序号字母)。
a.空气中SO2浓度过高会加重呼吸系统和心脑血管疾病
b.SO2、NOx、CO2的大量排放都会造成酸雨
c.氮的氧化物和碳氢化合物大量排放可能引发光化学烟雾
d.“静电除尘”、“燃煤固硫”、“低碳经济”都能改善空气质量
②发电厂产生的SO2尾气中的可直接用氨水吸收,变废为宝。若用15L 2.0 mol 氨水充分吸收4480L含10%的SO2硫酸尾气(气体体积已折算成标准状况)。充分反应后吸收液中的溶质为________。
氨水充分吸收4480L含10%的SO2硫酸尾气(气体体积已折算成标准状况)。充分反应后吸收液中的溶质为________。
③利用发电厂产生的SO2制成以水为电解质的SO2质子交换膜燃料电池,该电池电动势为1. 06V。电池工作时负极反应式为________。
(2)将发电厂产生的SO2通人含有Na2S、Na2CO3的废液中可制得Na2S2O3·5H2O,通人SO2过程中的现象是:通了一段时间后,产生气体并析出沉淀,沉淀量逐渐增多;沉淀量逐渐减少并形成清液;停止通SO2,过滤后母液经蒸发浓缩,冷却得Na2S2O3·5H2O晶体(提示:)。上述过程中析出沉淀时发生的氧化还原反应的化学方程式为:________。调节废液中Na2S和Na2CO3的物质的量之比为________,时可以恰好完全反应生成Na2S2O3·5H2O。
-
碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 •2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g •L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ• mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ• mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
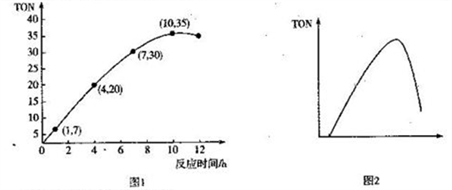
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g)  CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
已知:TON=
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
| 弱酸 | 碳酸 | 次氯酸 |
| 电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol • L-1 NaClO 溶液的 pH=________________。
-
研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
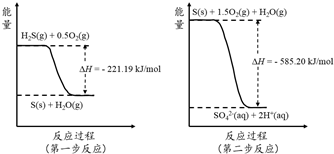
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.05 |
| 4 | 0.04 | 0.02 |
| 6 | 0.02 | |
| 8 | | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g) 和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。
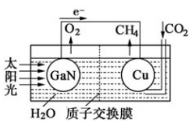
写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。
-
研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
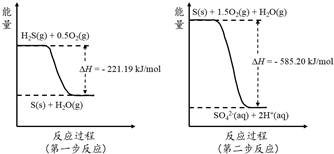
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.05 |
| 4 | 0.04 | 0.02 |
| 6 | 0.02 | |
| 8 | | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g)和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。
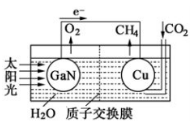
写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。
-
研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是________,潮湿条件下,写出大气中SO2转化为H2SO4的方程式________________________________.
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣,两步反应的能量变化如图一:1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为________________________________________
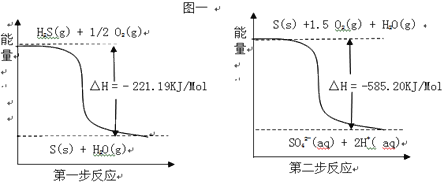
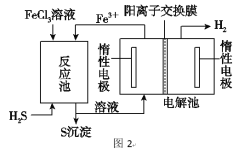
(3)利用H2S废气制取氢气的方法有多种,比如图的电化学法:
①该法制氢过程如图2,反应池中反应物的流向采用气、液逆流方式,其目的是_________;
②反应池中发生反应的化学方程式为_______________________;
③反应后的溶液进入电解池,产生氢气的电极名称为_________,电解反应的离子方程式为___________________。
-
氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
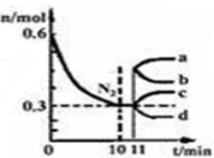
(1)氢气也可以作为化工生产的原料,如一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
(2)在工业上也可以利用氢气合成液体燃料。如:工业上合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
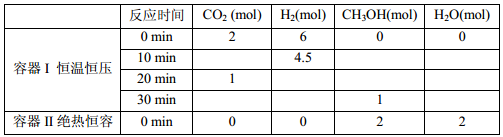
达到平衡时,反应I、II对比:平衡常数K(I)_______K(II)(填“>”“<”或“=”)。保持其他条件不变的情况下,若30 min时只向容器I中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。
(3) 100 kPa时,绝热密闭容器中发生反应2NO(g)+O2 (g) 2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
: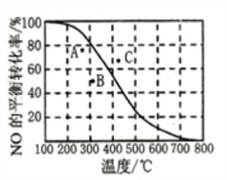
300℃时,VmL NO和0.5mLO2混合发生该反应,最终混合气体的平均摩尔质量为: _________(用含V的计算式表示)。图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则_____点对应的压强最大。若氧气中混有氮气,容器中还同时发生了如下反应N2(g)+O2(g)  2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。

N2(g) +
H2(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
N2(g) +
H2(g) 的活化能Eb=______kJ/mol。
2NO(g),该反应在不同温度下的平衡常数K如下表:
CH3OH(g)。若在一容积可变的密闭容器中充入1mol CO和2mol H2进行反应,初始体积为3L,保持压强不变,反应后CO的平衡转化率随温度(T) 的变化如右图中曲线所示。




















