-
氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
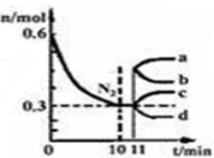
(1)氢气也可以作为化工生产的原料,如一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
(2)在工业上也可以利用氢气合成液体燃料。如:工业上合成甲醇的反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):
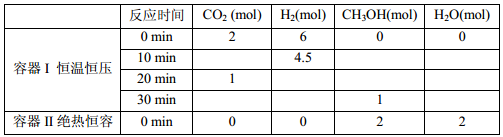
达到平衡时,反应I、II对比:平衡常数K(I)_______K(II)(填“>”“<”或“=”)。保持其他条件不变的情况下,若30 min时只向容器I中再充入1 mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”)。
(3) 100 kPa时,绝热密闭容器中发生反应2NO(g)+O2 (g) 2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。
: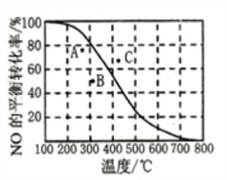
300℃时,VmL NO和0.5mLO2混合发生该反应,最终混合气体的平均摩尔质量为: _________(用含V的计算式表示)。图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则_____点对应的压强最大。若氧气中混有氮气,容器中还同时发生了如下反应N2(g)+O2(g)  2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
-
随着能源问题的进一步突出,氢能作为一种清洁、高效、安全、可持续的能源,被视为21世纪最具发展潜力的清洁能源,开发氢能已引起各国的高度重视.
Ⅰ.(1)生产氢气的方式很多,写出工业生产中采用煤为原料制取氢气的化学反应方程式: 。
(2)热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
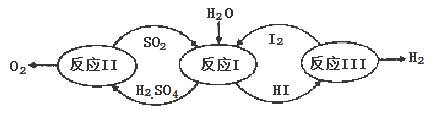
请回答下列问题;
①该循环工艺过程的总反应方程式为 .
②运用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出氢气的目的是 。
(3)最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4热化学循环制氢的反应可表示为:
2MnFe2O4 2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
2MnFe2O4-x+XO2↑,MnFe2O4-x+xH2O=MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问地:
① 在反应中MnFe2O4是 (填“催化剂”或“中间产物”),若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为 。
②该热化学循环法制氢尚有不足之处,进一步改进的研究方向是 .
Ⅱ.(4)氢能的利用涉及氢的储存、运输和使用,镍和镧组成的一种合金LaNiX ,是较好的储氢材料,能快速可逆地存储和释放氢气。LaNix 的晶胞如右图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixH6+6NiO(OH)  LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为: 。
LaNix+6NiO+6H2O,电池放电时,发生氧化反应的电极反应式为: 。

-
氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为___,B、C、N、O第一电离能由大到小的顺序为___,CH4、H2O、CO2的键角按照由大到小的顺序排列为___。
(2)与(HB=NH)3互为等电子体的有机分子为___(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
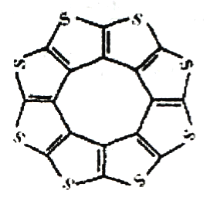
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
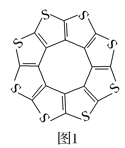
①C16S8分子中C原子和S原子的杂化轨道类型分别为___。
②相关键长数据如表所示:
| 化学键 | C—S | C=S | C16S8中碳硫键 |
| 键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___。
③C16S8与H2微粒间的作用力是___。
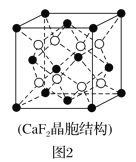
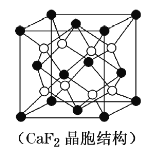
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___。
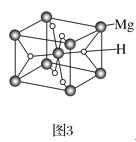
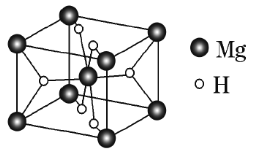
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
-
氢能被视为21世纪最具发展潜力的清洁能源,开发高效储氢材料是氢能利用的重要研究方向。
(1) 是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
是一种潜在的储氢材料,其中N原子的价电子排布式为________________。
(2) 的键角由大到小的顺序为________________________,
的键角由大到小的顺序为________________________, 的第一电离能由大到小的顺序为_______________________________。
的第一电离能由大到小的顺序为_______________________________。
(3) 是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
是新型环烯类储氢材料,研究证明其分子呈平面结构(如图所示)。
① 分子中
分子中 原子和
原子和 原子的杂化轨道类型分别为_________________________。
原子的杂化轨道类型分别为_________________________。
②测得 中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
中碳硫键的键长介于C-S键和C=S键之间,其原因可能是________________________________________________。
(4)某种铜银合金晶体具有储氢功能,它是面心立方最密堆积结构, 原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将
原子位于面心,Ag原子位于顶点,H原子可进入由Cu原子和Ag原子构成的四面体空隙中。若将 原子等同看待,该晶体储氢后的晶胞结构与
原子等同看待,该晶体储氢后的晶胞结构与 (如图)相似,该晶体储氢后的化学式为_________________________。
(如图)相似,该晶体储氢后的化学式为_________________________。
(5) 是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为
是金属氢化物储氢材料,其晶胞如图所示,该晶体的密度为 ,则该晶胞的体积为___________
,则该晶胞的体积为___________ (用含
(用含 的代数式表示)。
的代数式表示)。
-
氢能被视为最具发歸力的清洁能源,开发新型储氣材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如 下反应制得:3CH4+2 (HB=NH) 3+6H2O=3CO2+6H3BNH3
(1)基态B原子的价电子排布式为___________,B、C, N, O第一电离能由大到小的顺序为_________,CH4、H2O、CO2的键角按照由大到小的顺序排列为___________。
(2)与(HB=NH)3,互为等电子体的有机分子为___________(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
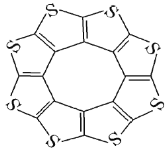
(1)印度尼赫鲁先进科学研宄中心的Datta和Pati等人借助ADF软件对一种新 型环烯类储氢材料(C16S8)进行研宄,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。
①C16S8分子中C原子和S原子的杂化轨道类型分别为___________。
②相关键长数据如表所示:
| 化学键 | C-S | C=S | C16S8中碳硫键 |
| 键长/pm | 181 | 155 | 176 |
从表中数据看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能______________________。
③C16S8与H2微粒间的作用力是___________。
(2)有储氢功能的铜合金晶体具有立方最密堆积结构,晶胞中Cu原子位于面心,Ag 原子位于顶点,氢原子可进到由Cu原子与Ag原子构成的四面体空隙中。该晶体储氢后的晶胞结构与CaF2(如图)相似,该晶体储氢后的化学式为___________。

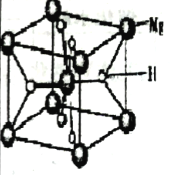
(3)MgH2是金属氢化物储氢材料,其晶胞如上图所示,该晶体的密度为ag•cm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
-
“氢能”被视为21世纪最具发展潜力的清洁能源。氢气的燃烧效率非常高,只要在汽油中加入4%的氢气,就可使内燃机节油40%。目前,氢能技术在美国、日本、欧盟等国家和地区已进入系统实施阶段。氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)H2S热分解制氢气时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是________。
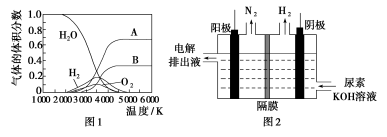
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为____________。
-
氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
(2)Bodensteins研究了如下反应:2HI(g) H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________

(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。
-
[2016·天津]氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是 (至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: 。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)  B(l) ΔH1
B(l) ΔH1
O2(g)+B(l)  A(l)+H2O2(l) ΔH2
A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)  H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
H2O2(l)的ΔH 0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是 。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4。同时获得氢气:Fe+2H2O+2OH−
 +3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色
+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
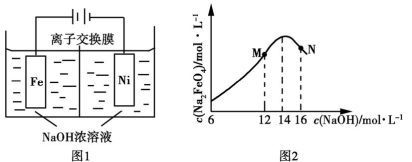
①电解一段时间后,c(OH−)降低的区域在 (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为 。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因: 。
-
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH− FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
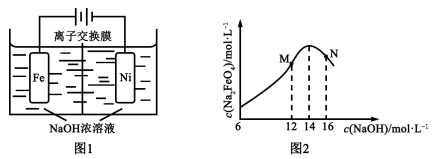
①电解一段时间后,c(OH−)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
-
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____0(填“>”、“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变
b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−  FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
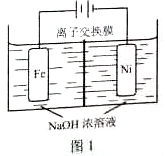
①电解一段时间后,c(OH−)降低的区域在_______(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______。
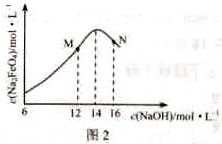
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c( Na2FeO4)低于最高值的原因:_____________。

2NH3(g),该反应的平衡常数表达式为:_________________。在2L的恒容密闭容器中加入1.8mol H2和0.6mol N2,其中N2的量随时间的变化曲线如图。从llmin起,在其它条件不变的情况下,压缩容器的体积为1L,则n(N2)的变化曲线为:_____________(填“a”或“b”或“c”或“d”), 达新平衡时,c(N2)的数值为:_________。
CH3OH(g)+H2O(g) △H<0,该过程既可以减弱CO2的温室效应,又可以充分利用CO2。反应过程中部分数据见下表(起始:T1℃、2.0L密闭容器):

2NO2(g)。一定压强下,NO的平衡转化率与温度的关系曲线如图所示。

2NO(g)△H=+180kJ/mol,则此反应对NO的转化率的影响是_________ (填“增大”、“减小”或“无法判断”),理由是______。
















