-
(1)已知:①Fe(s)+1/2O2(g)=FeO(s) ΔH1=-272.0kJ·mol-1;
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____(填“正”或“负”)极。F电极上的电极反应式为________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因______。
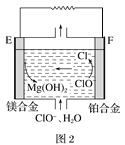
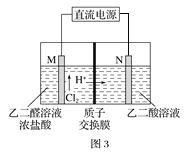
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___mol。
-
(1)已知:①Fe(s)+l/2O2(g)===FeO(s) △H1=—272.0 kJ/mol
②2Al(s)+3/2O2(g)==Al2O3(s) △H2=-1675.7 kJ/mol
A1和FeO发生铝热反应的热化学方程式是________________。
(2)如图所示的装置中发生反应2A2(g)+B2(g) 2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
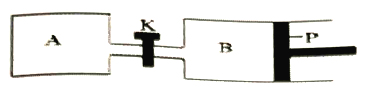
①此反应的平衡常数表达式为__________;若将温度升高到700℃,反应的平衡常数将____________(填“增大”、“减小”或“不变”)。
②比较大小:w1________w2(填“>”、“=”、“<”),a、b、c由大到小的关系___________。
③若打开K,一段时间后重新达平衡,容器B的体积将___________(填“增大”、“减小”或“不变”)。
④若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3mol·L-1,则 w1,w3的关系___________。
⑤能说明A中已达到平衡状态的是________(填序号,有一个或多个选项符合题意)。
A.υ(C)=2υ(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
-
(2分)已知:下列两个热化学方程式:
Fe(s) + 1/2O2(g)  FeO(s)
FeO(s)  =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)
Al2O3(s)  =-1675.7KJ/mol
=-1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是______________________________________________________ 。
-
(1)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________________________。某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由是_________________。
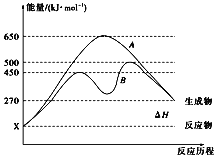
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
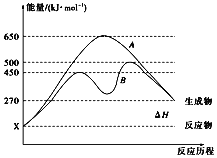
①据图判断该反应是________(填“吸”或“放”)热反应
②其中B历程表明此反应采用的条件为_____ (填字母)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
-
(1)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________________________。某同学认为,铝热反应可用于工业炼铁,你的判断是________(填“能”或“不能”),你的理由是_________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是________(填“吸”或“放”)热反应
②其中B历程表明此反应采用的条件为_____ (填字母)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
-
已知:下列两个热化学方程式:
Fe(s)+ O2(g)═FeO(s) △H=﹣272.0KJ/mol
O2(g)═FeO(s) △H=﹣272.0KJ/mol
2Al(s)+ O2(g)═Al2O3(s) △H=﹣1675.7KJ/mol
O2(g)═Al2O3(s) △H=﹣1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是 .
-
(11分)(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+ O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。

①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
-
(11分)(1)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+ O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。
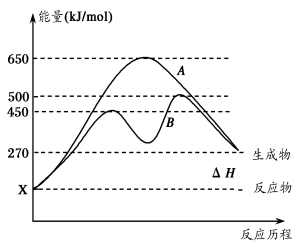
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
-
依据事实,写出下列反应的热化学方程式.
(1)已知:
Fe(s)+ O2(g)=FeO(s)△H=-272.0kJ•mol-1
O2(g)=FeO(s)△H=-272.0kJ•mol-1
2Al(s)+ O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
Al和FeO发生铝热反应的热化学方程式是______.
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444KJ,试写出氢气燃烧生成液态水的热化学方程式______
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______.
-
已知:Fe(s)+ O2(g)═FeO(s)△H1=-272kJ/mol,2Al(s)+
O2(g)═FeO(s)△H1=-272kJ/mol,2Al(s)+ O2(g)═Al2O3(s)△H2=-1 675kJ/mol,则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
O2(g)═Al2O3(s)△H2=-1 675kJ/mol,则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
A.-859 kJ/mol B.859 kJ/mol
C.-1403 kJ/mol D.-2491 kJ/mol






