-
有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g) N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
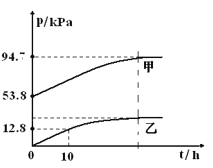
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPa•h-1),t=10h时,pN2O5=___kPa,υ=_________kPa•h-1(结果保留两位小数,下同)。
③该温度下2NO2 N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
-
有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g) N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:
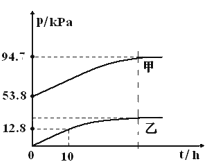
①上图中表示O2压强变化的曲线是_________(填“甲”或“乙”)。
②已知N2O5 分解的反应速率υ=0.12pN2O5(kPa•h-1),t=10h时,pN2O5=___kPa,υ=_________kPa•h-1(结果保留两位小数,下同)。
③该温度下2NO2 N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
-
党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO 和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g) +2NO(g)  N2(g) +2CO2(g) △H
N2(g) +2CO2(g) △H
① 已知下列热化学方程式:
N2(g) +O2(g) =2NO(g) △H1 = + 180.5kJ/mol
2C(s) +O2(g) =2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则 △H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2 表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2 各0.4mol,化学平衡将_____移动 (填“向左”“向右”或“不”)。
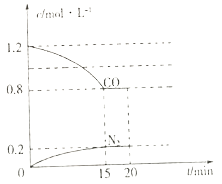
(2)在相同温度下,两个体积均为1L 的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
| 容器编号 | 起始物质的量/mol | 平衡物质的量/mol |
| NO | CO | N2 | CO2 | CO2 |
| I | 0.2 | 0.2 | 0 | 0 | a |
| II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K 为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO 催化转化进行研究。测得NO 转化为N 2的转化率随温度CO 混存量的变化情况如图所示。
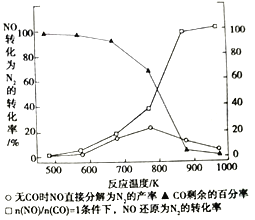
①在n(NO)/n(CO) =1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2 的转化率增大的原因是_______ (用平衡移动的原理解释)。
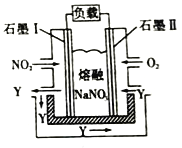
(4)以NO2、O2、熔融NaNO3 组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。
-
党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了 PM2.5外,还有 CO、SO2、氮氧化物(NO和 NO2)、O3等气体。
完成下列填空:
(1)S2- 的核外电子排布式为__________, N原子核外电子有______种不同运动状态。
(2)C、O、S、N 四种元素中原子半径最小的是________(写元素符号);写出一个比较O与N非金属性强弱的事实: _____________________________________________。
(3)汽车尾气中含有NO和CO气体,用以下反应除去:2CO(g) +2NO(g)  N2(g) +2CO2 (g) + Q
N2(g) +2CO2 (g) + Q
①该反应的平衡常数表达式为________________________;
②若增大压强,平衡常数__________(填“增大”、 “减小”或“不变”);
③若升高温度,逆反应速率先增大后减小,则 Q ______0(填“>”、 “<”或“=”)。
(4)某温度时,将 0.1mol CO和 0.1mol NO充入2L的密闭容器中,5s后测得生成 0.28g N2,则该时间内v(NO) = _______________。
-
十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ∆H < 0 平衡常数K1
NaNO3(s)+ClNO(g) ∆H < 0 平衡常数K1
2NO(g)+Cl2(g) 2ClNO(g) ∆H < 0 平衡常数K2
2ClNO(g) ∆H < 0 平衡常数K2
4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g) N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
| t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
| 甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
| 丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
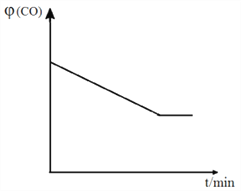
④ 已知甲容器CO的体积分数 (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下,  (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
-
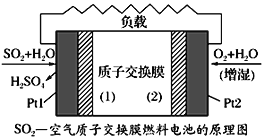
十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
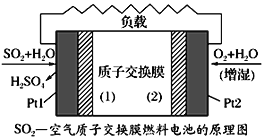
A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
-
十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
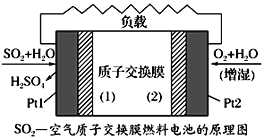
A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
-
十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
-
十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
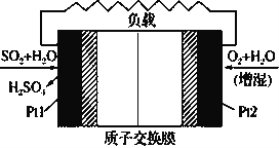
A.该电池放电时H+从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应:SO2+2H2O-2e-=H2SO4+2H+
C.Pt2电极附近发生的反应为: O2+2H2O+4e-=4OH-
D.放电过程中若消耗的22.4L O2(标准状况),Pt1电极区增加4mol H+
-
十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
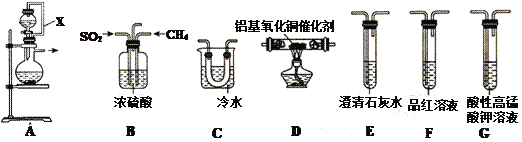
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 . 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2 随时间的变化如下图所示:

N2O4 反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。










 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。