-
完成下列问题:
(1)25℃时有下列4种溶液:
A.0.01mol/L氨水 B.0.01mol/LNaOH溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
请回答下列问题:
①上述4种溶液中,水的电离程度最大的是________(填序号)。
②若将B、C溶液等体积混合,所得溶液pH_______7(填“>”、“<”或“=”)
(2)已知25℃时
| 物质 | H3PO2 | H2S | 一元酸HA |
| Ka | Ka=5.9×10-2 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=1.1×10-10 |
①一元酸H3PO2的电离方程式为_________________________。
②H2S溶液与NaA溶液反应的化学方程式为________________。
③经测定,25℃时0.01mol/LNa2S溶液的pH为11,则c(H+)+c(HS-)+2c(H2S)=______。
④0.1mol/L的NaHS溶液,测得溶液显_______。则该溶液中c(H2S)____c(S2-)(填“>”、“<”或“=”),作出上述判断的依据是__________(用计算和文字解释)。
(3)①25℃时,亚硝酸的电离常数为Ka=1.0×10-5,0.2mol/L的HNO2溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HNO2分子浓度由大到小的顺序为_____________。
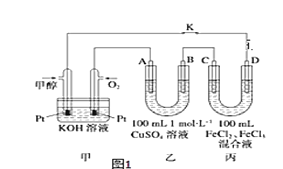
(4)如图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。
①甲中负极的电极反应式____________________。
②乙中B极的电极反应式____________________。
③丙中C极的电极反应式___________________。
-
已知:25℃时,下列4种溶液.请回答下列问题.
A.0.01mol•L﹣1氨水 B.0.01mol•L﹣1 NaOH溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
(1)①4种溶液中,水的电离程度最大的是 (填序号).
②若将C、D溶液分别稀释10倍,pH变化如图,曲线I对应的溶液为 (填序号).图中a、b、c三点对应溶液的导电能力由强到弱的顺序是 (用a、b、c表示)
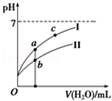
③若将VmL的D溶液滴入到45mL的B溶液中充分反应后,溶液PH=3,则V= mL(溶液体积变化忽略不计).
(2)请设计实验证明CH3COOH为弱酸 .
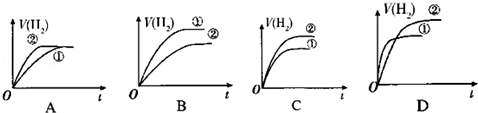
(3)相同体积的C溶液①和D溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是 .(请填序号)
-
25℃时,下列溶液中水的电离程度最小的是( )
A.pH=11的氨水 B.0.01mol/L的Ba(OH)2溶液
C.0.01mol/L的盐酸 D.pH=4的硫酸溶液
-
25℃时,下列溶液中水的电离程度最大的是( )
A.0.01 mol/L盐酸 B.pH =11氨水
C.pH = 4 NaHSO3溶液 D.0.01 mol/L Na2CO3溶液
-
25℃时,下列溶液中水的电离程度最小的是
A.pH=11的氨水 B.0.01 mol/L的Na2CO3溶液
C.0.01 mol/L的盐酸 D.pH=4的NaHSO3溶液
-
25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
-
25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
-
在25℃时,用蒸馏水稀释1 mol·L-1氨水至0.01 mol·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是

-
某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如右图所示:
(1)求该温度下,中性溶液的pH;
(2)求该温度下0.01mol/LNaOH溶液的PH;
(3)该温度下,pH=a的醋酸溶液与pH=b的NaOH溶液等体积混合,恰好完全反应,求此醋酸溶液中醋酸的电离度。

-
常温时,以下4种溶液pH最小的是
A.0.02mol/L醋酸溶液与等体积的水混合
B.0.02mol/L醋酸与0.02mol/LNaOH溶液等体积混合液
C.0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液



