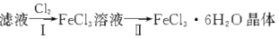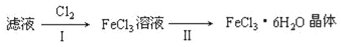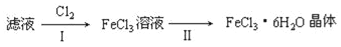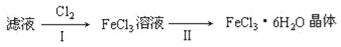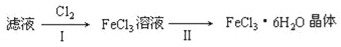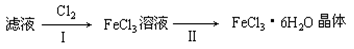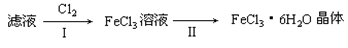-
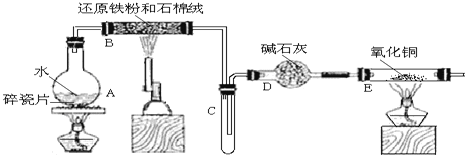
某校化学小组学生利用如图所列装置进行 “铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
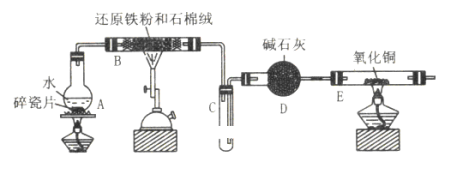
(1)装置B中发生反应的化学方程式是__。
(2)装置E中的现象是:__。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:__。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
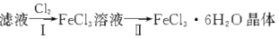
步骤I中通入Cl2的作用是__。
-
某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图所示:
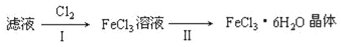
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括:_______。
-
某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图所示:
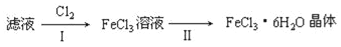
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括:_______。
-
某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图所示:
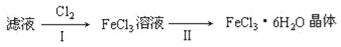
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括:_______。
-
某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
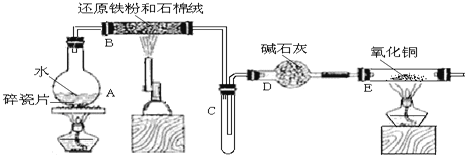
(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图所示:
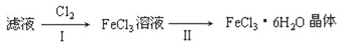
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括:_______。
【答案】3Fe+4H2O(g) Fe3O4+4H2黑色的粉末变成紫红色,管壁产生水珠Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2将Fe2+氧化成Fe3+取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色加热浓缩、冷却结晶、过滤
Fe3O4+4H2黑色的粉末变成紫红色,管壁产生水珠Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2将Fe2+氧化成Fe3+取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色加热浓缩、冷却结晶、过滤
【解析】
A中圆度烧瓶在加热条件下可提供水蒸气,B在加热条件下,铁与水蒸气反应生成四氧化三铁和氢气,氢气经干燥,在C中用向下排空法可收集到氢气,D为干燥装置,在加热条件下氢气与氧化铜反应生成铜和水,据此解答该题。
(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g) Fe3O4+4H2;
Fe3O4+4H2;
(2)装置B中铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠;
(3)在固体中加入过量稀盐酸后四氧化三铁、铁和盐酸以及铁和氯化铁之间发生反应,其方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,因此步骤I中通入Cl2的作用是将Fe2+氧化成Fe3+;
②检验三价铁应该用KSCN溶液,观察是否变红,即检验滤液中Fe3+的操作方法是:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
③由FeCl3稀溶液得到FeCl3•6H2O晶体需加热浓缩、冷却结晶、过滤。
【点睛】
本题考查了铁及其化合物的性质实验方案设计,题目难度不大,注意掌握铁与水蒸气反应原理,(3)中容易忽略铁在反应中可能过量,过量的铁能与盐酸和氯化铁反应,为易错点。
【题型】实验题
【结束】
19
实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
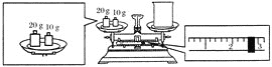
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:

①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
-
某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
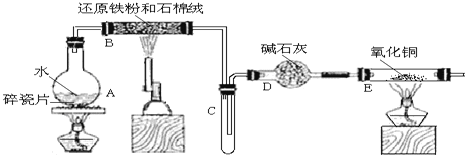
(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图所示:
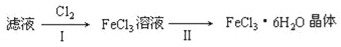
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括:_______。
-
某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
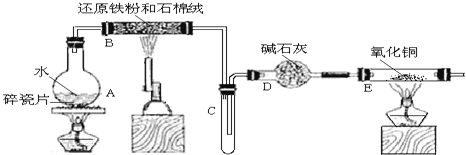
(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如图所示:

①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3•6H2O晶体的主要操作包括:_______。
-
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是________;
(2)装置E中的现象是________;
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3•6H2O晶体.
①欲检验溶液里含有Fe3+,选用的试剂为________,现象是________;
②该实验小组同学用上述试剂没有检验到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因________;
③将此溶液中FeCl2完全氧化为FeCl3,最好选择下列物质中的________
A.酸性KMnO4溶液B. Cl2 C. Na2O2 D. FeCl3
④在③所得溶液浓缩结晶前需要用实验证明FeCl2已完全氧化,实验方法是________。
-
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
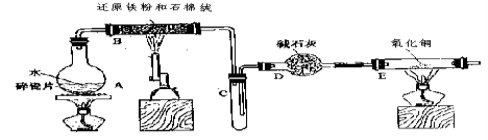
(1) 烧瓶底部放置了几片碎瓷片,
碎瓷片的作用是 。
装置B中发生反应的化学方程式是____________________________ ____。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是_ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
简述检验滤液中Fe3+的操作方法____________________________。
(4) 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
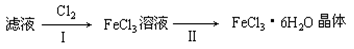
步骤I中通入Cl2的作用是________________________________。
-
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O 晶体。(图中夹持及尾气处理装置均已略去)
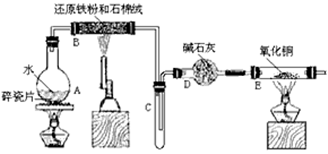
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
装置B中发生反应的化学方程式是 ____________________________
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 __________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
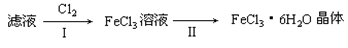
① 步骤I中通入Cl2的作用是____________________________。
② 步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:

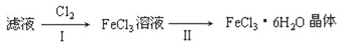
Fe3O4+4H2黑色的粉末变成紫红色,管壁产生水珠Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2将Fe2+氧化成Fe3+取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色加热浓缩、冷却结晶、过滤
Fe3O4+4H2;