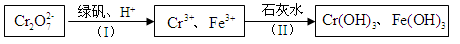-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1 NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(2)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2 mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)
H++A2-。常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
Ca2+(aq)+A2-(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
-
弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;水的电离程度将________(填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________(填字母)。
a. 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______。
(4)0.1 mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中 c(H2A)________c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________(用文字解释)。
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
(1)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为__________。
(2)已知常温时CH3COOH CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O CH3COOH + OH–的平衡常数Kh=______。
CH3COOH + OH–的平衡常数Kh=______。
(3)已知H2A在水中发生电离:H2A=H++HA–,HA– H++A2–。
H++A2–。
① 等物质的量浓度的两种溶液:NaHA溶液的pH_____(填“>”、“=”或“<”)Na2A溶液的pH。
② 已知0.1 mol·L-1 NaHA溶液的pH=2,该溶液中各种离子浓度由大到小的顺序是______。
③某温度下,若向0.1 mol·L–1的NaHA溶液中逐滴滴加0.1 mol·L–1 NaOH溶液至溶液呈中性。对该混合溶液,下列说法一定正确的是____(填序号)。
A.c(H+)·c(OH–)=1×10–14 B.c(Na+)=c(HA–)+2c(A2–)
C.溶液中水的电离程度逐渐减小 D.c(Na+)=c(HA–)+c(A2–)
(4)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.己知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-
H++A2-
(1)某温度下,若向0.1mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是__________。
A.c(H+)·c(OH-)=l.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol·L-1
(2)己知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
Ca2+(aq)+A2+(aq) △H>0。若要使该溶液中Ca2+浓度变小,可采取的措施有____________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:

(1)该废水中加入绿矾和H+,发生反应的离子方程式为________________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
-
(13分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性。则
①该溶液中c(H2A) c(A2-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
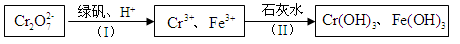
①绿矾为FeSO4·7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为 。
②常温下若处理后的废水中c(Cr3+)=6.0×10-7 mol·L-1,则处理后的废水的pH=______。(Ksp[Cr(OH) 3]=6.0×10-31)
-
(12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:
c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中c(H+) c(OH-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
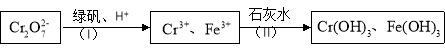
①绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为 。
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象 _______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________________________________。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________(填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________(用文字解释)。
-
弱电解质的电离平衡、盐类的水解平衡均属于溶液中的离子平衡。根据要求回答问題。
(1)常温下0.1mol·L-1的HA溶液中pH=3,则HA是______(填“强电解质”或“弱电解质”),其电离方程式____________________________________。
(2)已知:常温下0.1mol·L-1 BOH溶液pH=13,将V1L0.1mol·L-1HA溶液和V2L 0.1 mol·L-1BOH溶液混合,回答下列问题:
①当V1:V2=1:1时,溶液呈____性,请用离子方程式解释原因________________。
②当混合溶液pH=7时,溶液中离子浓度大小关系是_____________________。
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A = H++HA-,HA-⇌H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05 mol·L-1
(3)室温下若0.1mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中c(H+)______(填“>"、“<”或“=“)0.11 mol·L-1,理由为______________。
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴NaHA溶液__________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
⑵某温度下,0.1 mol/L的NaHA溶液,下列关系中,一定正确的是___________。
A.c(H+)·c(OH-)=1×10―14
B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
⑶已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp_______(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)__________。
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)= _________mol/L
II.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温 下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COOH + OH–的平衡常数Kh=______。
H++A2–。