-
某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
| 实验操作 | 预测现象 | 实验现象 |
| 向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
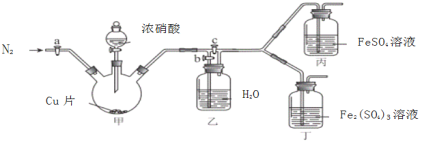
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
-
某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
| 实验操作 | 预测现象 | 实验现象 |
| 向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
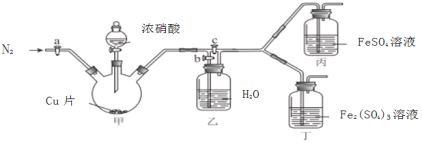
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。
-
某小组同学通过“FeSO4被浓HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
| 实验操作 | 预期现象 | 实验现象 |
| 向盛有2 mL FeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体,溶液变为深棕色 |
(1)红棕色气体是_______。
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明_______。
实验二:探究溶液变为深棕色的原因
(资料与猜想)
查阅资料后猜想,可能是生成的NO2或NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
(实验与探究)
用下图所示装置进行实验(气密性已检验,尾气处理已略去)
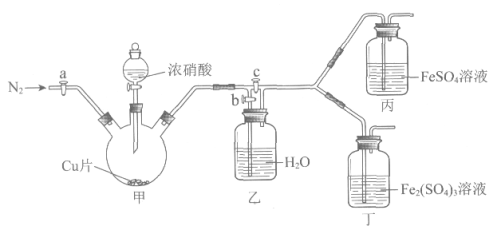
i. 关闭c,打开a和b,通入N2,一段时间后关闭a;
ii. 向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
iii. 关闭b、打开c,更换丙、丁中的溶液(试剂不变);
iv. 继续向甲中加入浓HNO3,一段时间后观察到了与ii相同的实验现象。
(1)通入N2的目的是________。
(2)铜与浓硝酸反应的化学方程式是________。
(3)装置乙的作用是________。
(4)实验结论是________。
(反思与改进)
实验三:验证Fe2+的还原性
该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是________。
-
为了“探究铁及其化合物的氧化性或还原性”,某同学甲设计了如下的实验方案。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是 。
(2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。
①若甲同学计划在0.1 mol·L-1 FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应
是 (写化学方程式),现象是:溶液由浅绿色变 色。
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选上述试剂中 滴入甲同学所得的混合液中,出现 现象,证明甲同学的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
-
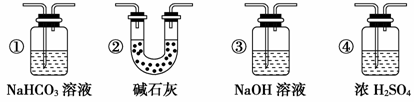
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
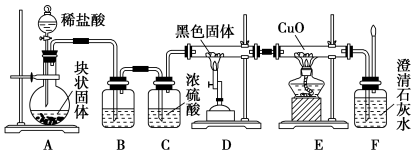
(1)按照如图装置进行实验时,首先进行的操作是 。
(2) B中的试剂是 ,D中反应的化学方程式为 。
(3) 根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
(4) 若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:
(5)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置 与 之间连接下图中的 装置(填序号)。
-
某氧化还原反应中有反应物和生成物共六种: NO、FeSO4、Fe(NO3)3、 H2O、 HNO3和 Fe2(SO4)3。其中 HNO3为反应物,则该反应中的还原剂为( )
A. NO B. FeSO4 C. Fe(NO3)3 D. Fe2(SO4)3
-
某氧化还原反应中有反应物和生成物共六种: NO、FeSO4、Fe(NO3)3、 H2O、 HNO3和 Fe2(SO4)3。其中 HNO3为反应物,则该反应中的还原剂为( )
A. NO B. FeSO4 C.Fe(NO3)3 D.Fe2(SO4)3
-
按要求填写下列实验报告:
| 实验内容 | 主要实验操作 | 主要结论 |
| ① | 除去FeSO4溶液中的少量Fe2(SO4)3, | ______,过滤 | 离子方程式为: |
| ② | 证明SO2既有漂白性又有还原性 | | 主要现象为: |
| ③ | 证明还原性:
I->Cl- | 取样,______
______. | 离子方程式为: |
| ④ | 证明CO2具有一定的氧化性(助燃性): | | 化学方程式为: |
-
某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3,其中FeSO4为反应物.则该反应中的还原产物为
A.Fe(NO3)3 B. HNO3 C. Fe2(SO4)3 D.NO
-
为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
实验操作 实验现象 离子反应 实验结论
A 在氯化亚铁溶液中滴加新制氯水 浅绿色溶液变成棕黄色溶液 2Fe2++Cl2=
2Fe3++2Cl- Fe2+具有还原性
B 在氯化亚铁溶液中加入锌片 浅绿色溶液变成无色溶液 Fe2++Zn=
Fe+Zn2+ Zn具有还原性
C 在氯化铁溶液中加入铁粉 棕黄色溶液变成浅绿色溶液 Fe3++Fe=
2Fe2+ 铁单质具有还原性
D 在氯化铁溶液中加入铜粉 蓝色溶液变成棕黄色溶液 2Fe3++Cu=
2Fe2++Cu2+ Fe3+具有氧化性




