-
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
| 稀硫酸(过量) | 浓NaOH溶液(过量) |
| AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
| Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。
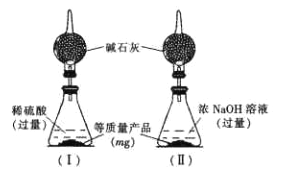
装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______(用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______(填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________。
②用少量酒精洗涤的目的__________________________。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________。
-
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路、陶瓷等生产领域。工业上由氧化铝与焦炭在氮气流中高温制得:Al2O3+3C+N2 2AlN+3CO。请回答:
2AlN+3CO。请回答:
(1)上述反应中氧化剂与还原剂的物质的量之比___________________。
(2)制得的氮化铝产品中常含有Al4C3、Al2O3和C等杂质,已知:
| 稀硫酸(过量) | 浓NaOH溶液(过量) |
| AlN | 2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4 | AlN+NaOH+H2O=NaAlO2+NH3 ↑ |
| Al4C3 | Al4C3+6H2SO4=2Al2(SO4)3+3CH4 ↑ | Al4C3+4NaOH+4H2O=4NaAlO2+3CH4 ↑ |
为测定产品中AlN和Al4C3的含量,设计了如下两套实验装置(在通风橱进行,可适当微热,忽略空气中水蒸气、CO2的影响及NH3在强碱性溶液中的溶解)。
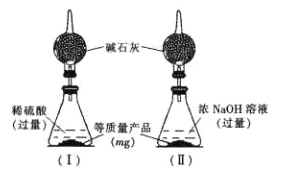
装置I、II在反应前后的质量差分别为m1 g和m2 g,则m g产品中AlN的质量分数为______(用含m、m1、m2的代数式表示)。
(3)取装置I中反应后的滤液,先加入少量(NH4)2SO4溶液,然后依次进行蒸发浓缩、冷却结晶、过滤、用少量酒精洗涤、滤纸吸干,得到铵明矾晶体[NH4Al(SO4)2·12H2O]。
①蒸发浓缩操作时,除需铁架台(带铁圈)、酒精灯、坩埚钳、玻璃棒外,还需要_______(填仪器名称);蒸发浓缩的操作;小火加热,不断搅拌,_________。
②用少量酒精洗涤的目的__________________________。
(4)已知:25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.8×10-5,Kb(Al(OH)3]=1.4×10-9。
① NH4Al(SO4)2溶液中离子浓度由大到小的顺序_________________。
②(NH4)2SO4溶液中存在水解平衡,则水解平衡常数为_____________。
-
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用Al2O3+3C+N2 2AlN+3CO制取氮化铝,设计下图实验装置:
2AlN+3CO制取氮化铝,设计下图实验装置:
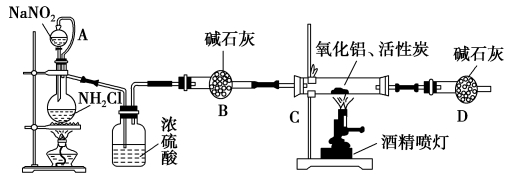
试回答:
(1)实验中用饱和NaNO2与NH4Cl溶液制取氮气的化学方程式为 。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是________(填写序号)。
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是________________。
(4)化学研究小组的装置存在严重问题,请说明改进的办法________________。
(5)反应结束后,某同学用图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。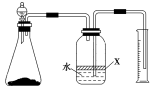
已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气。
①广口瓶中的试剂X最好选用________(填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将________(填“偏大”、“偏小”或“不变”)。
③若实验中称取氮化铝样品的质量为10.0 g,测得氨气的体积为3.36 L(标准状况),则样品中AlN的质量分数为________。
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO,下列叙述正确的是( )。
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3价
D.氮化铝属于复合材料
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C =2AlN+3CO 是;下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2molAlN,N2得到3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
-
氮化铝(AlN)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3 D.AlN的摩尔质量为41 g
-
氮化铝(AlN)具有耐高 温、抗冲击、导热性好等优良性质,被广泛应用于电子工业陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C 2AlN+3CO
下列叙述正确的是 ( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2molAlN,N2得到的3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
-
氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C
 2AlN+3CO合成.下列叙述正确的是( )
2AlN+3CO合成.下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41g
-
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应:
Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
-
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是氧化剂,被氧化
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
2AlN+3CO。请回答:



