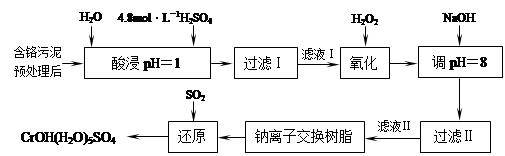-
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
已知: ① 硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、 Al3+、 Ca2+和Mg2+。
② Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
③ 常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol/L的浓硫酸配制500mL2mol/L的硫酸时除用量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有_________________________。
(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式__________。
(3)过滤II操作得到的滤渣主要为______(填化学式)。
(4)钠离子交换树脂的反应原理为: Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_________________。
(5)上述流程中,每还原1molCrO42-时,需要消耗SO2 _______ mol。
-
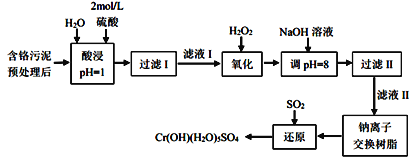
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。
(2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。
(4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。
(5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。
-
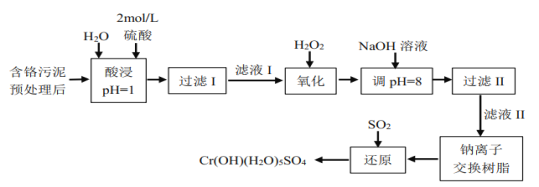
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)以难溶物CrOH(H2O)5SO4的形式回收,处理工艺流程如下:
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ | Ca2+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 | 13.9 |
(1)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式: _______________________。
(2)加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。但溶液的pH不能超过8,其理由是_______________
(3)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________。
(4)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
| 银盐 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 黄 | 白 | 砖红 | 白 |
| Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是________(填字母),滴定终点的现象是_________________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
-
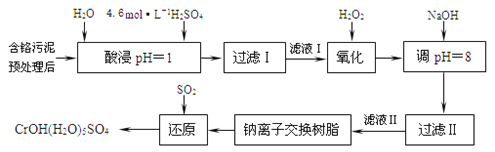
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
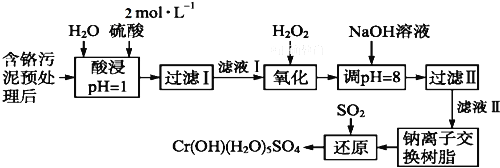
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_______mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,写出此反应的离子方程式:_______。
,写出此反应的离子方程式:_______。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O 转化为______(填微粒的化学式)
转化为______(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有_____________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式____________。
-
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
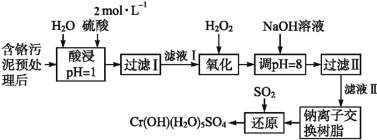
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_______________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需__________________________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_______________________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为____________(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:__________________________________________________________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
| 银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 黄 | 白 | 砖红 | 白 |
| Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是_____________(选填编号),滴定终点现象是:____________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN
-
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
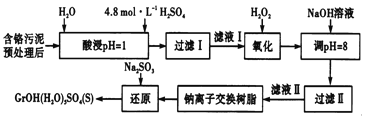
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ |
| 开始沉淀时的pH | 2.7 | — | — |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________(写一种方法即可).
-
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
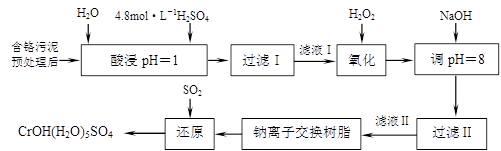
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需________________。
(2)酸浸时,为了提高浸取率可采取的措施有________________、
________________。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | —— | —— | —— |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是________________________。
(6)写出上述流程中用SO2进行还原的化学方程式。
-
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
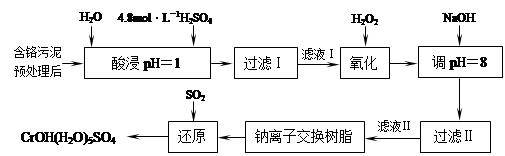
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需________________。
(2)酸浸时,为了提高浸取率可采取的措施有________________、
________________。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | —— | —— | —— |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是________________________。
(6)写出上述流程中用SO2进行还原的化学方程式。
-
Ⅰ利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(1)染料工业排放的废水中含有大量有毒的 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去 的离子方程式为_____________。
的离子方程式为_____________。
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | 
| 
| 
| 
| 
| 
|
| 开始沉淀时的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若 、
、 和
和 的浓度均为
的浓度均为 ,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中
,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中 和
和 的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓
的实验步骤:①__________;②___________;③过滤。(提供的药品:C12、浓 、NaOH溶液、CuO、Cu)。
、NaOH溶液、CuO、Cu)。
Ⅱ.下图表示某些化工生产的流程(部分反应条件和产物略去)
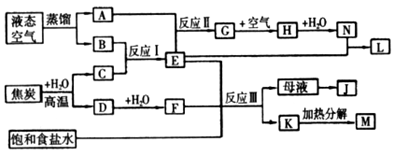
(1)反应Ⅰ需在500℃进行,其主要原因是_________________。
(2)G转化为H的过程中,需要不断补充空气,其原因是_________________。
(3)写出反应Ⅲ的化学方程式_________________。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是_________________(填序号)。
a. 增大 的浓度,使J更多地析出
的浓度,使J更多地析出
b. 使K更多地析出
c. 使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称_________________。
-
某工厂对制革工业污泥中铬的处理工艺流程如下:

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | — | — |
| 沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。

2CrO42-+2H+