-
阅读下列有关能源的材料,回答有关问题:
(1)在常温,1.01×105Pa时,48g 甲醇在足量的氧气中充分燃烧生成二氧化碳和液态水,放出1089kJ的热量,则表示甲醇燃烧热的热化学方程式为____________________________。
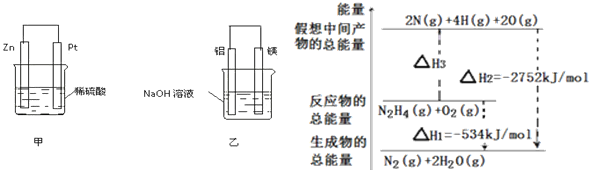
(2)在生产和生活中经常遇到化学能与电能的相互转化。在如图甲、乙两装置中,甲中负极电极反应式为____________________________,甲中的阳离子向 _______ 极移动(填“正”或“负”);乙中铝电极作____极,乙中正极电极反应式为____________________________
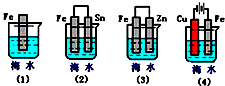
(3)肼(N2H4)可作为火箭发动机的燃料,有关肼化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为944、O=O为500、N-N为154,则反应物转化为中间产物的ΔH3=_________,断裂1 mol N—H键所需的能量是__________ kJ。
(4)工业制氢气的一个重要反应是:CO(g)+ H2O(g) =CO2(g) + H2(g),
已知25℃时: C(石墨)+O2(g) = CO2(g) ; △H1 = -394 kJ•mol-1
C(石墨)+ O2(g) = CO(g); △H2 = -111 kJ•mol-1
O2(g) = CO(g); △H2 = -111 kJ•mol-1
H2(g)+  O2 (g)=H2O(g); △H3= -242kJ•mol-1
O2 (g)=H2O(g); △H3= -242kJ•mol-1
试计算25℃时CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H=____________kJ•mol-1。
-
运用所学知识回答下列问题:
(1)常温下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:___。
(2)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s) ΔH=-989.2kJ·mol-1,有关键能数据如下表:
| 化学键 | Si—O | O=O | Si—Si |
| 键能/kJ·mol-1 | x | 498.8 | 176 |
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,则x的值为__。
(3)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是___。
(4)在稀释醋酸的过程中,下列始终保持增大趋势的量是(______)
A.c(H+) B.H+个数 C.CH3COOH分子数 D.
(5)某温度(t℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得混合溶液的pH=2,则a∶b=__。
(6)已知Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
-
下列关于燃烧热的说法中正确的是
A. 1 mol物质燃烧所放出的热量
B. 常温下,可燃物燃烧放出的热量
C. 在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D. 燃烧热随化学方程式前的化学计量数的改变而改变
-
下列关于燃烧热的说法中正确的是
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学方程式前的化学计量数的改变而改变
-
下列关于燃烧热的说法中正确的是
A.1 mol物质燃烧所放出的热量
B.常温下,可燃物燃烧放出的热量
C.在25°C、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随热化学方程式中的化学计量数的改变而改变
-
下列关于燃烧热的说法中正确的是( )
A.燃烧热是指1mol物质燃烧所放出的热量
B.燃烧热是指常温下,可燃物燃烧放出的热量
C.燃烧热是指1.01×105Pa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学计量数的改变而改变
-
写出下列反应的热化学方程式.
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式______
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol 在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______.
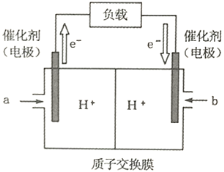
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是______(填序号)
-
为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
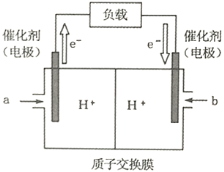
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
| 化学键 | H-H | N-H | N≡N |
| 键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。
-
为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
| 化学键 | H-H | N-H | N≡N |
| 键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。
-
已知在25 ℃、1.01×105 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如下图所示,下列有关说法正确的是( )
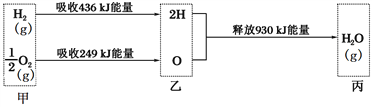
A.H2O分解为H2与O2时放出热量
B.热化学方程式为:2H2(g) + O2(g) = 2H2O(g) ΔH = -490 kJ·mol-1
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ

O2(g) = CO(g); △H2 = -111 kJ•mol-1
O2 (g)=H2O(g); △H3= -242kJ•mol-1



