-
已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业。
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol·L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
①25℃时,浓度均为0.1mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是___。中和等体积、等pH的HCOOH和HCN消耗NaOH的量___(填“前者大”“后者大”或“相等”)。
②下列关于0.1mol·L-1NaHC2O4溶液的说法正确的是___。
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示。又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是____
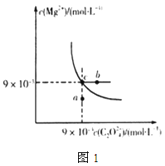
A.在t℃时,MgC2O4的Ksp=8.1×10-5mol2·L-2
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4(s)+2OH-(aq)⇌Mg(OH)2(s)+C2O42-(aq)平衡常数K=
(3)草酸亚铁晶体(FeC2O4·2H2O)是一种浅黄色固体,难溶于水,受热易分解。某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
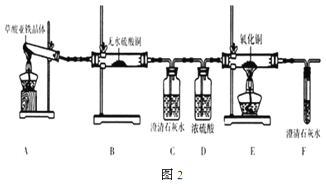
①从环保角度考虑,该套实验装置的明显缺陷是___。
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃___(填“A”或“E”)处的酒精灯。
③若实验过程中观察到B中白色无水CuSO4变成蓝色,___(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2。
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4·2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g。若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为___。草酸亚铁晶体分解的化学方程式为___。
-
已知草酸为二元弱酸:H2C2O4 HC2O4-+H+ ka1 HC2O4-
HC2O4-+H+ ka1 HC2O4- C2O42-+H+
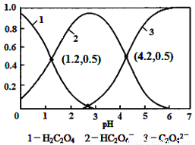
C2O42-+H+ 常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
常温下向某浓度的草酸溶液中逐滴加入一定量浓度KOH溶液,所得溶液H2C2O4、HC2O4-、C2O42-三种微粒物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
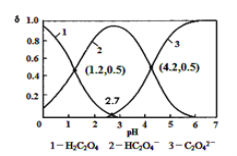
A. pH=1.2溶液中:c(K+)+c(H+) = c(OH-)+c(H2C2O4)(由图知)
B. pH=2.7溶液中: 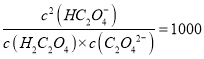
C. 将相同物质的量KHC2O4和K2C2O4固体溶于水可配得pH为4.2混合液
D. 向pH=1.2溶液中滴加KOH溶液,pH增大至4.2的过程中水电离程度一直增大
-
已知草酸为二元弱酸H2C2O4 HC2O4-+H+,Ka1;HC2O4-
HC2O4-+H+,Ka1;HC2O4- C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42-+H+ Ka1;常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
A. pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4)
B. pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
-
已知草酸为二元弱酸:
H2C2O4 HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4- C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
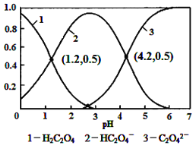
A.pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一定增大
-
已知草酸为二元弱酸:
H2C2O4 HC2O
HC2O +H+ Ka1
+H+ Ka1
HC2O
 C2O
C2O +H+ Ka2
+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是
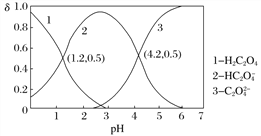
A. pH=1.2的溶液中:c(K+)+c(H+)=c(OH−)+c(H2C2O4)
B. pH=2.7的溶液中: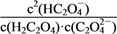 =1 000
=1 000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
-
已知草酸为二元弱酸:
H2C2O4 HC2O
HC2O +H+ Ka1
+H+ Ka1
HC2O
 C2O
C2O +H+ Ka2
+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是
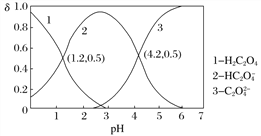
A. pH=1.2的溶液中:c(K+)+c(H+)=c(OH−)+c(H2C2O4)
B. pH=2.7的溶液中: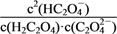 =1 000
=1 000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
-
三氯氧磷 广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸
广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸 。请回答下列问题:
。请回答下列问题:
 已知亚磷酸
已知亚磷酸 为二元弱酸,则
为二元弱酸,则 溶液中,各离子浓度的大小关系为________。
溶液中,各离子浓度的大小关系为________。
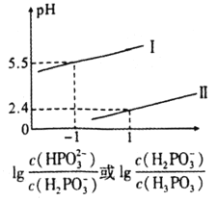
 常温下,将NaOH溶液滴加到亚磷酸
常温下,将NaOH溶液滴加到亚磷酸 溶液中,混合溶液pH与离子浓度变化的关系如图所示。则表示
溶液中,混合溶液pH与离子浓度变化的关系如图所示。则表示 的是曲线________
的是曲线________ 填“Ⅰ”或“Ⅱ”
填“Ⅰ”或“Ⅱ” ,亚磷酸
,亚磷酸 的
的 ________,反应
________,反应 的平衡常数值是________。
的平衡常数值是________。
 工业上生产三氯氧磷的同时会产生含磷废水
工业上生产三氯氧磷的同时会产生含磷废水 主要成分为
主要成分为 、
、 。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中
。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中 ,则溶液中
,则溶液中 ________
________ 。
。 已知
已知 )
)
-
已知草酸为二元弱酸:H2C2O4 HC2O4-+ H+ Ka 1 ; HC2O4-
HC2O4-+ H+ Ka 1 ; HC2O4- C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
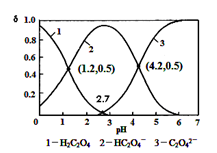
A.常温下,Ka 1 :Ka 2 =1000
B.将相同物质的量 KHC2O4 和 K2C2O4 固体完全溶于水可配得 pH 为 4.2 的混合液
C.pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4)
D.向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
-
已知草酸为二元弱酸:
H2C2O4 HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4- C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
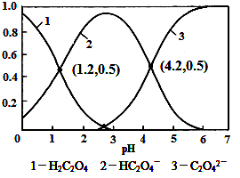
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
-
已知草酸为二元弱酸:
H2C2O4 HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4- C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
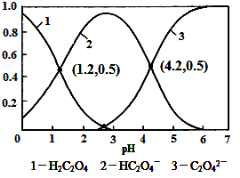
A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大



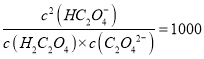



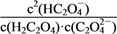 =1 000
=1 000
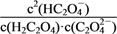 =1 000
=1 000


