-
A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子。回答下列问题:
(1)E2+的简化电子排布式是__________;甲和乙沸点较高的是___________(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是_________
(3)同时由A、B、C、D四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式___________
(4)由B、D、E三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为__________
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是___________________
高三化学推断题中等难度题查看答案及解析
-
A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子。回答下列问题:
(1)E2+的简化电子排布式是__________;甲和乙沸点较高的是___________(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是_________
(3)同时由A、B、C、D四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式___________
(4)由B、D、E三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为__________
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是___________________
高三化学推断题中等难度题查看答案及解析
-
X、Y、Z、W、M五种短周期主族元素,原子序数依次增大,已知X为原子半径最小的元素,Y的最高正化合价和最低负化合价的代数和为0,Z可以与X形成原子个数比为1∶1和1∶2的两种液态化合物,W是地壳中含量最高的金属元素,M的单质是一种黄绿色气体,则下列叙述正确的是
A. 原子半径的大小关系W>M>Z>Y>X
B. Y和M的含氧酸的酸性,前者一定比后者弱
C. YX4与M的单质在光照条件下的反应产物最多有4种物质
D. X、Y、W的单质均可用于冶炼金属的还原剂
高三化学单选题中等难度题查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3。根据以上叙述,下列说法中正确的是
A.以上四种元素的原子半径大小为W<X<Y<Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
高三化学选择题困难题查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3。根据以上叙述,下列说法中正确的是
A.原子半径大小为W<X<Y<Z
B.W与X、Y、Z分别形成最简单化合物中最稳定的是Z
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
高三化学选择题中等难度题查看答案及解析
-
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;A元素与C元素可形成两种液态化合物,其原子个数比分别为1:1和2:1,旦分子中电子总数分别为18和10;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。
(1)写出D元素的原子结构示意图________;E元素在周期表中位置________
(2)C和E两种元素相比较,非金属性较强的是(填元素符号)________,可以验证该结论的是________(填写编号)
A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(3)写出D的氢氧化物在水中发生酸式电离的电离方程式:________
欲使上述体系中D的简单阳离子浓度增加,可加入的物质是________
(4)B元素与C元素形成的化合物中,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是________
高三化学填空题中等难度题查看答案及解析
-
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;A元素与C元素可形成两种液态化合物,其原子个数比分别为1:1和2:1,分子中电子总数分别为18和10;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.
(1)写出D元素的原子结构示意图______;E元素在周期表中位置______;
(2)C和E两种元素相比较,非金属性较强的是(填元素符号)______,可以验证该结论的是______;(填写编号)
A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易 C.比较这两种元素的气态氢化物的稳定性
(3)写出D的氢氧化物在水中发生酸式电离的电离方程式:______,欲使上述体系中D的简单阳离子浓度增加,可加入的物质是______;
(4)B元素与C元素形成的化合物中,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是______.高三化学解答题中等难度题查看答案及解析
-
现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
(1)A分别与B、C形成的最简单化合物中,稳定性________>________(用分子式表示),其中A与B形成的最简单化合物分子的空间构型为________;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为________。
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是________;
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈________性(填“酸”、“碱”或“中”),用离子方程式解释原因________;
(5)写出实验室制取单质E的离子方程式是________。
高三化学填空题中等难度题查看答案及解析
-
现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
(1)A分别与B、C形成的最简单化合物中,稳定性 > (用分子式表示),其中A与B形成的最简单化合物分子的空间构型为 ;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为 。
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是 ;
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈 性(填“酸”、“碱”或“中”),用离子方程式解释原因 ;
(5)写出实验室制取单质E的离子方程式是 。
高三化学推断题困难题查看答案及解析
-
(12分)甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
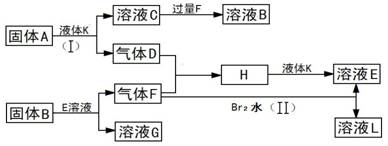
试回答:
(1)甲元素的名称为________,溴元素在周期表的位置________丁元素的阴离子结构示意图为________。
(2)A的电子式为________;所含化学键类型为________。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示)________。
(4)反应(I)的化学方程式为________。
(5)反应(II)的离子方程式为。
高三化学填空题中等难度题查看答案及解析