-
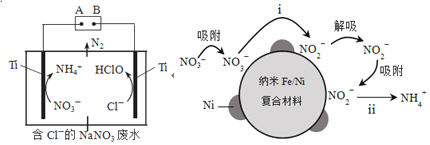
用纳米Fe/Ni复合材料能去除污染水体的NO3−,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3−分两步,将步骤ii补充完整:
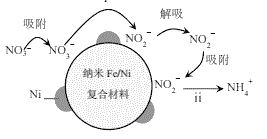
ⅰ.NO3−+Fe+2H+=NO2−+Fe2++H2O
ⅱ.□ +□ +□H+=□Fe2++□ +□ ______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因_________。
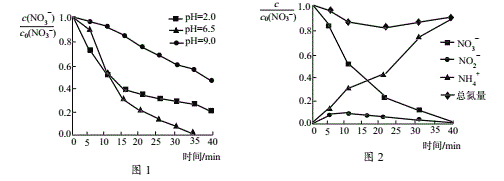
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图1所示。(注:c0(NO3−)为初始时NO3−的浓度。)
①为达到最高去除率,应调水体的初始pH=______。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是_______。
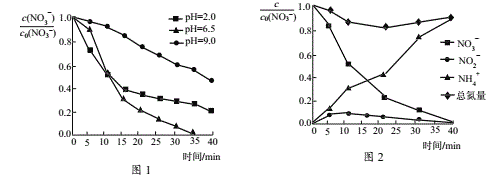
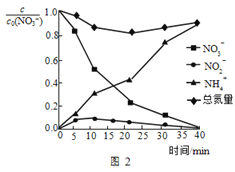
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是_____。
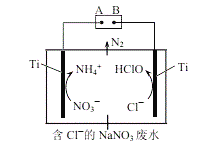
(5)利用电解无害化处理水体中的NO3−,最终生成N2逸出。其装置及转化图如图所示:
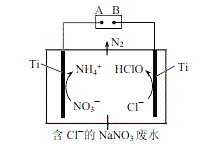
①阴极的电极反应式为___________。
②生成N2的离子方程式为_________。
-
用纳米Fe/Ni复合材料能去除污染水体的NO3-,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3-分两步,将步骤ii补充完整:
Ⅰ.NO3-+Fe+2H+=NO2-+Fe2++H2O
Ⅱ.___+___+___H+=___Fe2++___+___
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因___。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中 随时间的变化如图1所示。(注:c0(NO3-)为初始时NO3-的浓度。)
随时间的变化如图1所示。(注:c0(NO3-)为初始时NO3-的浓度。)
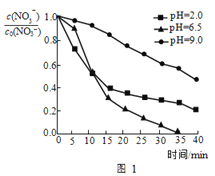
①为达到最高去除率,应调水体的初始pH=___。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是___。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是___。
(5)利用电解无害化处理水体中的NO3-,最终生成N2逸出。其装置及转化图如图所示:
①阴极的电极反应式为___。
②生成N2的离子方程式为___。
-
用纳米Fe/Ni复合材料能去除污染水体的NO3−,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(NH4+无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO3−分两步,将步骤ii补充完整:
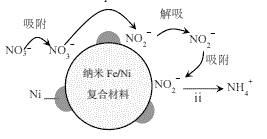
ⅰ.NO3−+Fe+2H+=NO2−+Fe2++H2O
ⅱ.□ +□ +□H+=□Fe2++□ +□ ______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因_________。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中随时间的变化如图1所示。(注:c0(NO3−)为初始时NO3−的浓度。)
①为达到最高去除率,应调水体的初始pH=______。
②t<15min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是_______。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,随时间的变化如图2所示。40min时总氮量较初始时下降,可能的原因是_____。
(5)利用电解无害化处理水体中的NO3−,最终生成N2逸出。其装置及转化图如图所示:
①阴极的电极反应式为___________。
②生成N2的离子方程式为_________。
-
化学与生产、生活、技术密切相关。下列说法正确的是
A. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
B. “水滴石穿”不仅包含着“量变到质变”的哲学思想,同时也包含物理和化学变化
C. 节日燃放的烟花,是碱金属、锶、钡、铂、铁等金属元素焰色反应呈现的
D. 工厂中常用的静电除尘装置是根据胶体带电性的性质而设计的
-
下列说法正确的是
A. 纳米铁粉可以高效地去除被污染水体中的 Pb2+、 Cu2+、 Cd2+、 Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附
B. 凡含有添加剂的食物对人体健康均有害,不宜食用
C. 煤经过气化和液化等物理变化可以转化为清洁燃料
D. 火力发电中,燃烧是使化学能转换为电能的关键
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 纳米铁粉有很好的吸附性 | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子 |
| B | 硅胶可以和水发生化学反应 | 硅胶作袋装食品的干燥剂 |
| C | SO2有毒 | 能做食品防腐剂 |
| D | 肥皂水显碱性 | 肥皂水作蚊虫叮咬处的清洗剂 |
A.A B.B C.C D.D
-
下列叙述Ⅰ和Ⅱ均正确并用因果关系的是
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 纳米铁粉有很好的吸附性 | 纳米铁粉可以高效地去除被污染水体中 的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子 |
| B | 硅胶可以和水发生化学反应 | 硅胶作袋装食品的干燥剂 |
| C | SO3有毒 | 不能做食品防腐剂 |
| D | 肥皂水显碱性 | 肥皂水作蚊虫叮咬处的清洗剂 |
A. A B. B C. C D. D
-
用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是( )
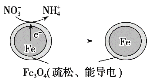
A. 能量转化形式主要为化学能转化为电能
B. 电极材料分别为Fe和Fe3O4
C. 负极反应为NO3-+8e-+10H+===NH4++3H2O
D. 该原理的总反应可表示为NO3-+3Fe+2H++H2O===NH4++Fe3O4
-
用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是
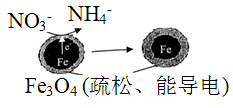
A. 能量转化形式主要为化学能转化为电能
B. 电极材料分别为Fe和Fe3O4
C. 负极反应为:NO3-+8e-+l0H+==NH4++3H2O
D. 该原理的总反应可表示为:NO3-+3Fe+2H++H2O= NH4+ +Fe3O4
-
化学与生活密切相关。下列说法不正确的是
A. 氦气化学性质稳定、密度小,可用于填充飞艇、气球
B. 镁铝合金质量轻、强度大,可用作高铁车厢材料
C. 纳米铁粉有较强的物理吸附作用,可去除水体中的Cu2+、Cd2+、Hg2+等重金属离子
D. K2FeO4是强氧化剂,还原产物铁离子水解生成氢氧化铁胶体,可作为净水剂










