-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO2为1.4 mol,同时放出热量Q kJ。则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为65.3
B.若反应开始时容器体积为2 L,则有v(SO3)=0.35 mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
A.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
B.2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低
C.若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol
D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
-
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
A.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
B.2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低
C.若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol
D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
-
一定条件下将2.3 mol SO2气体和1.2 mol O2气体充入一容积可变的密闭容器中,可滑动活塞的位置如图1所示,在恒温恒压下发生如下反应: 2SO2(g)+ O2(g) 2SO3(g),其中△H < 0 ,当反应达到平衡时,活塞位置如图2所示:
2SO2(g)+ O2(g) 2SO3(g),其中△H < 0 ,当反应达到平衡时,活塞位置如图2所示:

(1)平衡时SO2转化率为 (计算结果精确至1%);
(2)该条件下反应的平衡常数为 (保留三位有效数字);
(3)讨论温度对该反应中SO2转化率的影响 。
-
(1)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2 (g)⇌2SO3 (g);△H=-196kJ•mol-1.2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ.请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)______
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化
D.容器内气体密度不再发生变化
②从反应开始至达到化学平衡,生成SO3平均反应速率为______;该条件下反应的平衡常数K=______(精确到小数点后两位)
③反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气
④上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).
再通入1.6molSO2、0.8molO2、0.4molSO3,______;再通入0.2molSO2、0.2molSO3,______.
(2)工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等.已知25℃时,Ksp(CaSO4)=7.10×10-5.向0.100L 含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将______.
-
(I)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)═2SO3(g);△H=-196kJ•mol-1.2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ.请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)______
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为______;该条件下反应的平衡常数K=______(精确到小数点后两位)
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气
(4)上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).
①再通入1.6molSO2、0.8molO2、0.4molSO3,______;
②再通入0.2molSO2、0.2molSO3,______.
(II)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
已知:
2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g).△H=2a kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4KJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
则a=______.
-
(1)t℃时,将2molSO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2 (g) 2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
2SO3 (g);ΔH=-196kJ·mol-1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2kJ。请填写下列空白:①下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
②从反应开始至达到化学平衡,生成SO3平均反应速率为________;该条件下反应的平衡常数K=________(精确到小数点后两位)
③反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是________
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气
④上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不移动).
再通入1.6molSO2、0.8molO2、0.4molSO3,________;再通入0.2molSO2、0.2molSO3,_____
(2)工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将(填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 ______ 。
-
(4分)恒温条件下,将2.0molSO2与amolO2混合通入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
求:⑴a的值。
⑵平衡时SO2的转化率。
-
在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)
 2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molSO21molO2 | 2molSO3 | 4molSO22molO2 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(1)若初始投入amolSO2、bmolO2和cmolSO3,在相同条件下,要达到与甲相同的化学平衡,则a、c与b、c间应满足的代数关系式为________、________.
(2)该温度下此反应的平衡常数值为________,若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是V正________V 逆
(3)三个容器中的反应分别达平衡时各组数据关系正确的是________
A.α1+α2=1 B.Q1+Q2=196 C.α3<α1
D.P3<2P1=2P2E.n2<n3<3.2mol F.Q3=2Q1
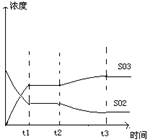
(4)如图表示甲反应在t1时刻达到化学平衡,在t2时刻因改变某个条件而发生变化的情况,则t2时刻改变的条件可能是________或________.
-
在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)
 2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molSO21molO2 | 2molSO3 | 4molSO22molO2 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(1)若初始投入amolSO2、bmolO2和cmolSO3,在相同条件下,要达到与甲相同的化学平衡,则a、c与b、c间应满足的代数关系式为________、________.
(2)该温度下此反应的平衡常数值为________,若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是V正________V 逆
(3)三个容器中的反应分别达平衡时各组数据关系正确的是________
A.α1+α2=1 B.Q1+Q2=196 C.α3<α1
D.P3<2P1=2P2E.n2<n3<3.2mol F.Q3=2Q1
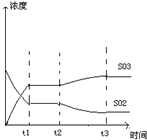
(4)如图表示甲反应在t1时刻达到化学平衡,在t2时刻因改变某个条件而发生变化的情况,则t2时刻改变的条件可能是________或________.
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是

