-
钴的合金及其配合物用途非常广泛。已知Co3+比Fe3+的氧化性更强,在水溶液中不能大量存在。
(1)Co3+的核外电子排布式为__________________________。
(2)无水CoCl2的熔点为735℃、沸点为1049℃,FeCl3熔点为306℃、沸点为315℃。CoCl2属于_________晶体,FeCl3属于__________晶体。
(3)BNCP可用于激光起爆器等,可由HClO4、CTCN、NaNT共反应制备。
① 的空间构型为______________。
的空间构型为______________。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_______{已知  的结构式为
的结构式为 }。
}。
③NaNT可以 (双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(4)Co与CO作用可生成Co2(CO)8,其结构如图所示。该分子中C原子的杂化方式为_________________。

(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为___________。已知NA为阿伏加德罗常数的数值,则该晶胞的密度为__________(用含a、b、NA的代数式表示)g·cm-3。
-
铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)基态Fe2+的核外电子排布式为__。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:__。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为__。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是__。(已知CO32-的结构式为 )
)
③NaNT可以 (双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol
(双聚氰胺)为原料制备,双聚氰胺中碳原子杂化轨道类型为__,1mol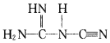 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。
④[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为__。
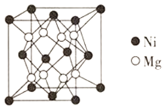
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为___。晶胞中离1个Mn原子最近的Ni原子有__个。
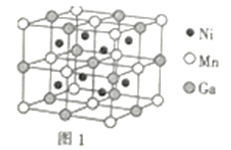
(4)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图2所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,则镍镁晶体未储氢时的密度为__(列出计算表达式,NA表示阿伏加德罗常数的数值)g•cm-3。

-
铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
⑴基态Fe2+的核外电子排布式为____。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_____。
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________。
②CTCN的化学式为 ,与Co3+形成配位键的原子是________。(已知CO32−的结构式为
,与Co3+形成配位键的原子是________。(已知CO32−的结构式为 )
)
③ 可以
可以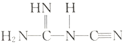 (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,
 中含有σ键的物质的量为________。
中含有σ键的物质的量为________。
④ 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为________。
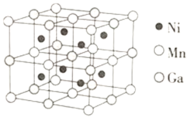
⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________(列出计算表达式,NA表示阿伏加德罗常数的数值) g∙cm-3。
-
(选做题)本题包括A、B两小题。请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
钴的合金及其配合物用途非常广泛。
(1)Co3+基态核外电子排布式为_____。
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为_____。

(3)BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为_____(用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_____(已知CO32—的结构式为: )。
)。
③NaNT可由 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含 键的数目为_____。
键的数目为_____。
B.[实验化学]
EDTA(乙二胺四乙酸)是螯合剂的代表物(沸点为116~117.2℃),可用于制备EDTAFeNa·3H2O等。实验室制备EDTA的实验步骤如下:
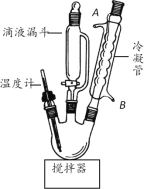
步骤1:在三口烧瓶中加入22.5gClCH2COOH、45mLH2O搅拌至溶解;在不断搅拌下,将含22gNaOH、60mLH2O、6.6g H2NCH2CH2NH2的盐酸盐所配成的溶液,从滴液漏斗中不断滴加到三口烧瓶中。
步骤2:加料完毕后,升温到102~106℃并保温,调节并保持 pH约为9,搅拌2h。
步骤3:加入活性炭,搅拌、静置、过滤。
步骤4:滤液用盐酸酸化至pH=1,放置、结晶、过滤、洗涤、干燥,制得EDTA。
(1)图中冷凝管装置的作用是_____,水从接口_____(填标号)通入。
(2)步骤3中加入活性炭的目的是_____;测定溶液pH的方法是_____。
(3)步骤4中“洗涤”时,能说明已洗涤完全的方法是_____。
(4)请补充完整由EDTA、NaHCO3、FeCl3·6H2O为原料制备EDTAFeNa·3H2O的实验方案(已知EDTANa4+FeCl3 EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
-
Fe与Si形成的合金及铁的配合物用途非常广泛,回答下列问题:
(1)基态Fe2+核外价电子排布式为________;在基态Si原子中,核外存在_____对自旋方向相反的电子。
(2)Fe78Si9B13是一种非晶合金,可通过________方法区分晶体和非晶体。
(3)硅烯是一种具有石墨烯结构的新型二维材料,二硅烯Si2H4分子的几何构型为____,依据电子云的重叠方式可知其所含共价键类型是________。
(4)配合物[Fe(Htrz)3](ClO4) 2 (Htrz为 ,1,2,4-三氮唑)
,1,2,4-三氮唑)
①与Fe2+形成配位键的原子是_______;已知分子中的大 键可用
键可用  符号表示,其中m代表参与形成大
符号表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数,则配体
键的电子数,则配体 中的大
中的大 键应表示为_____
键应表示为_____
②1,2,4-三氮唑的沸点为260 ℃,环戊二烯( )的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
)的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
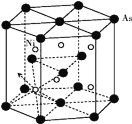
(5)砷化镍晶胞的结构如下图所示,1个砷化镍晶胞中含________个As;若六棱柱底边边长为a cm,高为c cm,阿伏加德罗数的值为NA,则砷化镍的密度为____g/cm3。
-
镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为___________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:________、___________、_________。
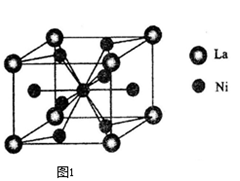
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构示意图如图1所示.则该晶体的化学式为 _________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式。
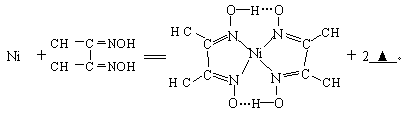
与Ni2+配位的N原子有______ 个,该配合物中存在的化学键有__________(填序号)。
A.共价键 B 离子键 C 配位键 D 金属键 E 氢键
-
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
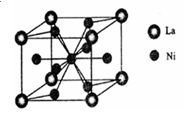
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
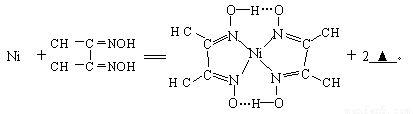
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
-
自然界中存在大量的金属元素和非金属元素,它们在工农业生产中有着广泛的应用。
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定。
①画出基态Cu原子的价电子轨道排布图____________;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因____________。
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①Cu(NH3)4SO4·H2O晶体中存在的化学键有____________(填字母序号)。
a.离子键 b.极性键 c.非极性键 d.配位键
②SO42—的立体构型是____________,其中S原子的杂化轨道类型是____________。
③已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是__________________。
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是____________。
(4)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),该反应是:
[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
[Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为____________;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为_________。
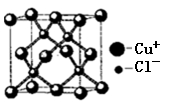
(5)铜的化合物种类很多,右图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为:ρ=____________g/cm3(用NA表示阿伏加德罗常数)。
-
下列说法中正确的是( )
A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金
C.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂
D.合成纤维和光导纤维都是高分子化合物
-
下列说法中正确的是
A.硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B.青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金.
C.漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂
D.合成纤维和光导纤维都是高分子化合物
的空间构型为______________。
的结构式为
 }。
}。 (双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
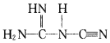 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。

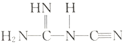 (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________, 中含有σ键的物质的量为________。
中含有σ键的物质的量为________。


 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含





