-
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于___________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式____________;两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能最大的为_______(用元素符号表示)。
(4)铜与Cl形成化合物的晶胞如图所示(黑点代表铜原子)。
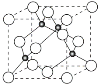
①该晶体的化学式为________。它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为___________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
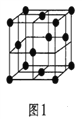
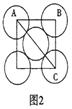
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
(8分)铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝元素在周期表中位置 ,铝离子的结构示意图为 。
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是 。制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为 。
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是 (填字母序号)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对。 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错。 |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错。 |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对。 |
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为________(填化学式)。
-
前四周期的元素及其化合物在生产、生活、化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式_________________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_______。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_______________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
(4)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 ______ (填元素符号)
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO4-的空间构型为_______形,C1O2- 中Cl原子的杂化方式为_________。
③元素C、O、F、H的电负性由大到小的顺序为______________________。
-
碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___ (填字母)。
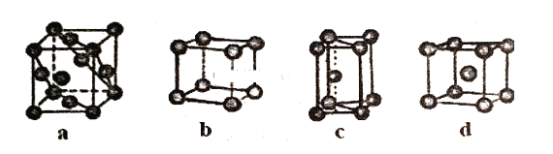
-
铁及其化合物在生产和生活中有着广泛的应用。
(1)铁元素在元素周期表中的位置为_____。
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为_____,铁在高温条件下与水蒸气反应的化学方程式为______________。
(3)高铁酸钾(K2FeO4)也是常用的水处理剂。它的制备方法有多种:其中熔融法又称为过氧化钠氧化法。先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2 Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因:_______________________________________ 。
Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因:_______________________________________ 。
-
铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
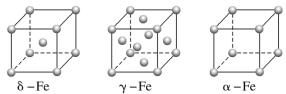
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为__,δ、α两种晶胞中铁原子的配位数之比为__。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__(填晶体类型)。
(3)铜晶体中铜原子的堆积方式为__,晶胞中原子的空间利用率为__。
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①如图表示的是___(填“CuCl2”或“CuCl”)的晶胞,其中Cl-的配位数为__。
②已知铜和Cl的电负性分别为1.9和3.0,则铜与Cl形成的化合物属于__(填“离子”或“共价”)化合物。
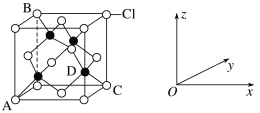
③原子坐标参数表示晶胞内部各原子的相对位置。图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为__。
-
镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是__________________。
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

该工艺中可循环使用的物质有______________。
(3)储氢材料Mg(AlH4)2在110~200 ℃的反应为Mg(AlH4)2=MgH2+2Al+3H2↑,每转移6 mol电子生成氢气的物质的量为________mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.100 0 g产品用适量硝酸溶解,经稀释等步骤最终配得500 mL的溶液。
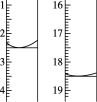
a.准确量取25.00 mL 待测液,用0.100 0 mol/L AgNO3标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为________mL。
b.
| AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 淡黄 | 黄 | 砖红 |
参照上表数据及信息分析,滴定时可以作指示剂的是________(填数字序号)。
①CaCl2 ②NaBr ③NaI ④K2CrO4
-
金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。

图5
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为 。
②Fe的一种晶胞结构如图5所示,测得晶胞边长为 a pm,
则Fe原子半径为 。
③已知FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为 。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体
是 ;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,图6所示的结构示意图中呈亮黄色的是 (填“A”或“B”),理由是 。

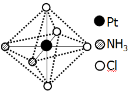
A B
图6
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图7。

图7
①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为 。
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为 。(不必计算出结果)
-
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题:
(1)单质铁属于_______晶体。黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中一个反应为3FeS2+8O2 6SO2+Fe3O4,氧化产物为_________,若有3molFeS2参加反应,转移_______mol电子。
6SO2+Fe3O4,氧化产物为_________,若有3molFeS2参加反应,转移_______mol电子。
(2)铝的价电子排布式为_________,明矾用作净水剂,其原理为_______________(用离子方程式表示)。
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,Cu与氨水、双氧水反应的离子方程式_______________;
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL5mol•L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,参加反应的铁粉的质量为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。











