-
工业合成氨的反应如下:3H2+N2 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
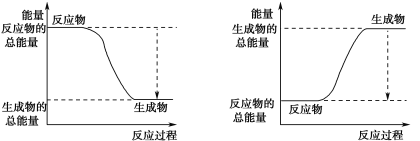
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
-
工业合成氨的反应如下:3H2+N2 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A.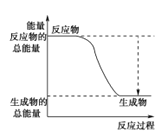 B.
B.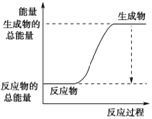
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变
-
工业合成氨的反应如下:3H2+N2 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率υ (N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
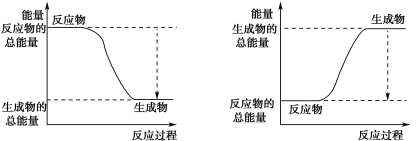
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
-
已知一定温度下,在2L的密闭容器中,合成氨反应N2(g)+3H2(g) 2NH3(g)的各物质数据如下:
2NH3(g)的各物质数据如下:
| N2 | H2 | NH3 |
| 起始时各物质的物质的量/mol | 2.0 | 6.0 | 0 |
| 2s末各物质的物质的量/mol | 1.2 | 3.6 | 1.6 |
以氢气来表示该化学反应的反应速率为( )
A.0.2mol·L-1·s-1 B.0.4mol·L-1·s-1
C.0.6mol·L-1·s-1 D.0.8mol·L-1·s-1
-
已知一定温度下,在2 L的密闭容器中,合成氨反应N2(g)+3H2(g)  2NH3(g)的各物质数据如下:
2NH3(g)的各物质数据如下:
| N2 | H2 | NH3 |
| 起始时各物质的物质的量/mol | 2.0 | 6.0 | 0 |
| 2 s末各物质的物质的量/mol | 1.2 | 3.6 | 1.6 |
以氨气来表示该化学反应的反应速率为( )
A. 0.2 mol·L-1·s-1 B. 0.4 mol·L-1·s-1
C. 0.6 mol·L-1·s-1 D. 0.8 mol·L-1·s-1
-
往一容积为10L的密闭容器中充入2mol N2、4mol H2进行合成氨反应N2+3H2
 2NH3.5min后达到平衡,该合成反应5min内的速率v(NH3)=0.02mol/.试求平衡时,容器中N2转化率是多少?(要求有解题过程)
2NH3.5min后达到平衡,该合成反应5min内的速率v(NH3)=0.02mol/.试求平衡时,容器中N2转化率是多少?(要求有解题过程)
-
在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H2 2NH3,反应进行到2min时达到平衡状态,测得容器内有2molN2,求:
2NH3,反应进行到2min时达到平衡状态,测得容器内有2molN2,求:
(1)2min内的平均速率υ(NH3)?
(2)反应前后容器中气体压强之比?
(3)NH3的分解率?
-
(10分)在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H2 2NH3,反应进行到2min时,测得容器内有2molN2,
2NH3,反应进行到2min时,测得容器内有2molN2,
求:(1)2min时的N2的浓度?
(2)2min内的平均速率υ(NH3)?
(3)反应前后容器中气体压强之比?
(4)NH3的分解率?
-
(共10分)已知合成氨反应为:N2 + 3H2 2NH3,在一定温度下,向2L密闭容器中,加入2molN2和5molH2,一定条件下使之反应,经过2min后达到平衡状态并测得NH3为0.4mol,求:
2NH3,在一定温度下,向2L密闭容器中,加入2molN2和5molH2,一定条件下使之反应,经过2min后达到平衡状态并测得NH3为0.4mol,求:
(1)以N2表示这2min内该反应的反应速率?
(2)此时氢气的转化率?
(3)平衡时NH3的体积分数?(保留1位小数)
(4)平衡时容器中的压强与开始压强之比?
(5)平衡时容器中气体的平均摩尔质量?
-
某温度下,在一固定容积的密闭容器中进行如下反应N2+3H22NH3,下列情况一定能说明反应已达到限度的是________.(填序号)
①单位时间内,有1molN2反应掉,同时有1molN2生成.
②单位时间内,有3molH2反应掉,同时有2molNH3生成.
③单位时间内,有1molN2生成,同时有2molNH3生成.
④单位时间内,有1molN2生成,同时有3molH2生成.
⑤用N2、H2、NH3表示的该反应的化学反应速率之比为1:3:2.
⑥容器内气体的总质量不再改变.
⑦容器内,C(N2)、C(H2)、C(NH3)不再改变.
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
 B.
B.


 2NH3(g)的各物质数据如下:
2NH3(g)的各物质数据如下: 2NH3(g)的各物质数据如下:
2NH3(g)的各物质数据如下: