-
合理利用和转化PCl5、NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)已知:P4(s) + 6Cl2(g) = 4PCl3(g) △H1= c kJ•mol-1
P4(s) +10Cl2(g) = 4PCl5(g) △H2= d kJ•mol-1
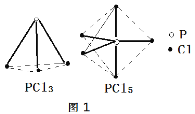
PCl3、PCl5分子的结构如图,其中实线表示化学键。若断开PCl5分子中1mol P-Cl键,平均消耗x kJ的能量,断开PCl3中1mol P-Cl键消耗1.2x kJ的能量。
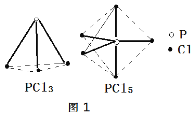
①写出PCl3与Cl2反应的热化学方程式_______。(热值用c、d表示)
②断开1mol的Cl-Cl键消耗的能量为________。
(2)NOx的排放主要来自于汽车尾气,利用反应:C(s)+2NO(g) N2(g)+CO2(g) ΔH = -34.0 kJ•mol-1 ;用活性炭对NO进行吸附。已知在恒压密闭容器中加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如图2所示:
N2(g)+CO2(g) ΔH = -34.0 kJ•mol-1 ;用活性炭对NO进行吸附。已知在恒压密闭容器中加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如图2所示:
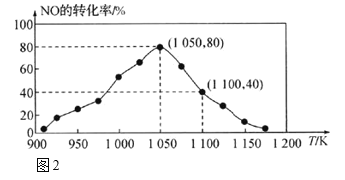
①由图2可知,反应在温度1050K之前,NO的转化率随温度升高而增大,其原因是_______;在1100K时,CO2的体积分数为___。
②用物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________。[已知:气体分压P分=气体总压(P总)×气体物质的量分数]
(3)反应N2O4(g) 2NO2(g) ΔH > 0 ,在一定条件下N2O4与NO2的消耗速率与各自的分压有如下关系:υ(N2O4)=k1·p(N2O4);υ(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图3所示。
2NO2(g) ΔH > 0 ,在一定条件下N2O4与NO2的消耗速率与各自的分压有如下关系:υ(N2O4)=k1·p(N2O4);υ(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图3所示。
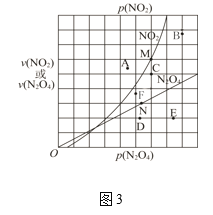
①在T℃时,图3中M、N点能表示该反应达到平衡状态,理由是________。
②改变温度,υ(NO2)会由M点变为A、B或C,υ(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,NO2和N2O4相对应的点分别是___、 ___(填字母)
(4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图4所示。
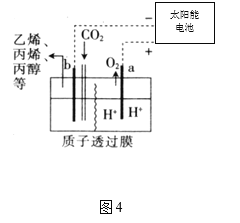
①a极发生________(填“氧化”或“还原”)反应。
②电解时,b极上生成乙烯的电极反应为________。
-
合理利用和转化PCl5、NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)已知:P4(s) + 6Cl2(g) = 4PCl3(g) △H1= c kJ•mol-1
P4(s) +10Cl2(g) = 4PCl5(g) △H2= d kJ•mol-1
PCl3、PCl5分子的结构如图,其中实线表示化学键。若断开PCl5分子中1mol P-Cl键,平均消耗x kJ的能量,断开PCl3中1mol P-Cl键消耗1.2x kJ的能量。
①写出PCl3与Cl2反应的热化学方程式_______。(热值用c、d表示)
②断开1mol的Cl-Cl键消耗的能量为________。
(2)NOx的排放主要来自于汽车尾气,利用反应:C(s)+2NO(g) N2(g)+CO2(g) ΔH = -34.0 kJ•mol-1 ;用活性炭对NO进行吸附。已知在恒压密闭容器中加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如图2所示:
N2(g)+CO2(g) ΔH = -34.0 kJ•mol-1 ;用活性炭对NO进行吸附。已知在恒压密闭容器中加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如图2所示:
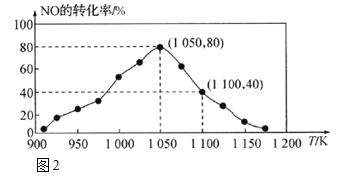
①由图2可知,反应在温度1050K之前,NO的转化率随温度升高而增大,其原因是_______;在1100K时,CO2的体积分数为___。
②用物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________。[已知:气体分压P分=气体总压(P总)×气体物质的量分数]
(3)反应N2O4(g) 2NO2(g) ΔH > 0 ,在一定条件下N2O4与NO2的消耗速率与各自的分压有如下关系:υ(N2O4)=k1·p(N2O4);υ(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图3所示。
2NO2(g) ΔH > 0 ,在一定条件下N2O4与NO2的消耗速率与各自的分压有如下关系:υ(N2O4)=k1·p(N2O4);υ(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图3所示。
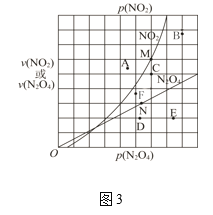
①在T℃时,图3中M、N点能表示该反应达到平衡状态,理由是________。
②改变温度,υ(NO2)会由M点变为A、B或C,υ(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,NO2和N2O4相对应的点分别是___、 ___(填字母)
(4)据报道,以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图4所示。
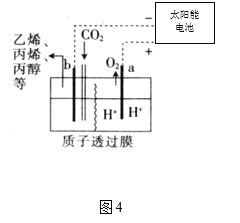
①a极发生________(填“氧化”或“还原”)反应。
②电解时,b极上生成乙烯的电极反应为________。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol–1
2SO3(g) ΔH=−196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol–1
2NO2(g) ΔH=−113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
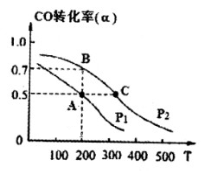
A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
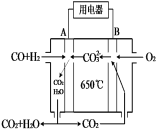
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol–1
2SO3(g) ΔH=−196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol–1
2NO2(g) ΔH=−113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
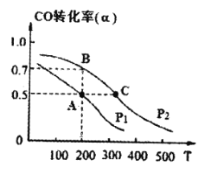

A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
(2)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol–1
2SO3(g) ΔH=−196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol–1
2NO2(g) ΔH=−113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则该反应的平衡常数K= 。
(3)汽车尾气中的一氧化碳可通过如下反应降低其浓度:CO(g)+1/2O2(g) CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
| 容器编号 | c(CO)/mol·L–1 | c(O2)/mol·L–1 | c(CO2)/mol·L–1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10–4 | 4.0×10–4 | 4.0×10–4 | υ(正)=υ(逆) |
| ② | 1.0×10–3 | 4.0×10–4 | 5.0×10–4 | υ(正) υ(逆) |
-
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.N2和CO2的体积比保持不变 D.v正(CO)=2v逆(N2)
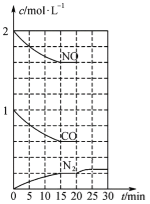
②20min时,若改变反应条件,导致N2浓度发生如下图所示的变化,则改变的条件可能是______(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g)  SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)
SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)

A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图回答问题。
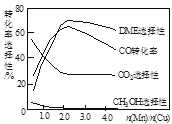
催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g) CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH |
| 平衡 时的 数据 | CH3OH浓度/mol·L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强/Pa | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
下列说法中正确的是____________
A.2c1>c3 B.a+b=92.9 C.2p2<p3 D.α1+α3<1
-
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
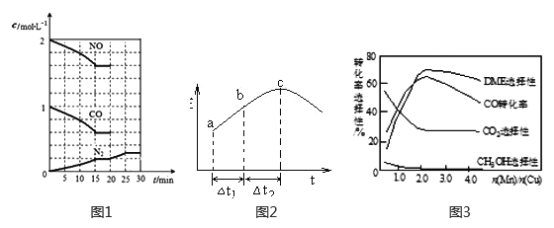
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g)  SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g) CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH |
| 平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强/Pa | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
-
“绿水青山就是金山银山”,现今“环境保护”意识深入人心。氮的氧化物是大气主要污染物,研究氮氧化物间的相互转化及脱除,让空气更加清洁是环境科学的重要课题。
(1)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步 2NO(g) N2O2(g) (快速平衡)
N2O2(g) (快速平衡)
第二步 N2O2(g)+O2(g)=2NO2(g) (慢反应)
①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数(与温度有关),则 _________。
_________。
②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是_________(填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能大于第二步反应的活化能
C.反应的总活化能小于第一步和第二步反应的活化能之和
(2)已知:反应N2(g)+O2(g) 2NO(g) ΔH=+180.0 kJ·mol-1,CO的燃烧热ΔH=-283.5 kJ·mol-1,某脱硝反应的平衡常数表达式为
2NO(g) ΔH=+180.0 kJ·mol-1,CO的燃烧热ΔH=-283.5 kJ·mol-1,某脱硝反应的平衡常数表达式为 ,则该反应的热化学方程式为_________________________。
,则该反应的热化学方程式为_________________________。
(3)用活性炭还原法也可以处理氮氧化物,某研究小组在2 L的恒容密闭容器中加入3 mol活性炭和2 mol NO2,发生反应2C(s)+2NO2(g) N2(g)+2CO2(g),60 min后,体系达到平衡状态,此时气体的压强变为原来的1.3倍,请回答下列问题。
N2(g)+2CO2(g),60 min后,体系达到平衡状态,此时气体的压强变为原来的1.3倍,请回答下列问题。
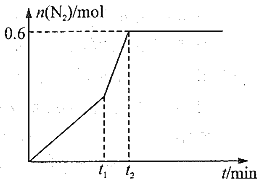
①该反应在0~60 min的平均反应速率v(N2)=_________。
②相同条件下进行上述反应,若在t1时刻,只改变一种条件,所得N2的物质的量随时间的变化如图所示,则,t1时刻改变的条件是_________(填选项编号A.加压 B.加入催化剂 C.升温 D.降温 E.通入NO2),t2_________60 min(填“大于”、“小于”或“等于”)
③已知:升高温度,该反应的平衡常数减小,则该反应正向是_________反应。(填“吸热”或“放热”)保持温度不变,改为恒压容器发生该反应,达平衡后,NO2的转化率_________(填“增大”、“减小”或“不变”,下同),K值_________。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用ClO2氧化氮氧化物反应过程如下:
NO NO2
NO2 无污染物
无污染物
反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,反应Ⅱ的化学方程式是__________________________。
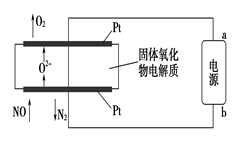
(2)利用固体氧化物电解池通过电解方式分解氮氧化物的过程如图3所示,写出电解池中通入NO一端的电极反应式:_______________________。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
①则NO2 与SO2反应的热化学方程式为______________________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_____________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
e.混合气体的平均分子量不再变化
③测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡时NO2的转化率=____________。
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol-1
2SO3(g) ΔH=−196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =−113.0 kJ·mol-1
2NO2(g) ΔH =−113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH = kJ·mol-1。
SO3(g)+NO(g)的ΔH = kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
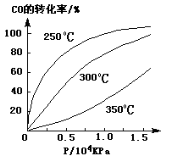
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。

N2(g)+CO2(g) ΔH = -34.0 kJ•mol-1 ;用活性炭对NO进行吸附。已知在恒压密闭容器中加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如图2所示:

2NO2(g) ΔH > 0 ,在一定条件下N2O4与NO2的消耗速率与各自的分压有如下关系:υ(N2O4)=k1·p(N2O4);υ(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图3所示。
















