-
(10分)二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:
步骤①:称取a g I2,(加少量KI助溶),配成1L 5×10-3mol·L-1溶液;
步骤②:取步骤①中溶液10mL,稀释至100mL;
步骤③:量取步骤②中溶液5.00mL于试管2中,加入2~3滴淀粉溶液;
步骤④:如图抽气N次至溶液蓝色刚好褪去。
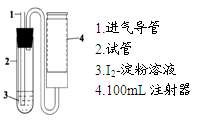
(1)步骤①中配制1L溶液时,除用到天平、药匙、烧杯、量筒、玻璃棒、胶头滴管外,还用到的玻璃仪器有 ;需称量单质碘的质量a为 (保留小数点后两位)。
(2)SO2与碘水反应的离子方程式为 。
(3)实验时,注射器每次缓缓抽气100mL。
①若抽气太快,将导致结果 (选填:“偏大”、“偏小”、“不变”)。
②若某次实验时抽气共80次,试计算该地空气中SO2的含量(mg/L) (写出计算过程)。
-
节日期间因燃放鞭炮会引起空气中SO2含量增高.造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量
(1)他们设计如下实验装置,请你参与探究并回答问题
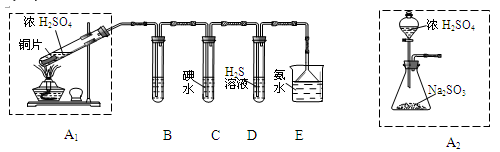
①装置A1中发生反应的化学方程式为________________________。
②装置B用于检验SO2的漂白性,其中所盛试剂为_________,装置D中实验现象为_______________。
③装置C中反应的离子方程式为___________________________________。
④为了实现绿色环保的目标。 甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写两点)________________________________________________________________。
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)
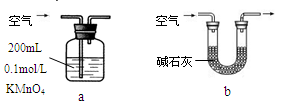
你认为哪个装置可行(填序号)__________,使用你所选用的装置测定SO2含量时,还需要测定的物理量是______________________________;不可行的请说明理由___________________________。
-
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积。该小组设计的简单实验装置如图所示:
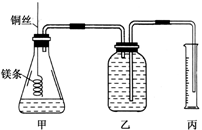
该实验的主要操作步骤如下:
①配制质量分数为36.5%的盐酸(假设其密度为1g/cm3);
②量取10.0mL该盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为___________;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题.
(1)题中涉及反应的化学方程式为___________。
(2)实验步骤⑤中应选用___________(填序号)的量筒.
A.1000mL B.2000mL C.5000mL
读数时除恢复到室温外,还要注意___________;
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ___________,若未除去镁条表面的氧化膜,则测量结果___________(填“偏大”、“偏小”或“无影响”)。
-
二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+ H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________ 。(任写一点即可)
-
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组拟用下列装置定量分析空气中SO2的含量:

(1)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,SO2在该反应中是___________(填“氧化剂”或“还原剂”)。
(2)通入空气前应进行的实验操作是___________。
(3)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为____________g/L。(写出计算过程)
-
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与反应).某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
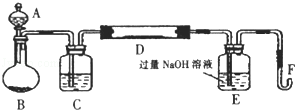
Ⅰ.实验装置如下图所示(夹持和加热装置已省略).A中的试剂是双氧水,将m1g该硫铁矿样品放人硬质玻璃管D中.从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全.
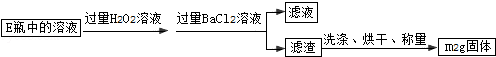
Ⅱ.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
Ⅲ.测定铁元素含量的实验步骤如下:
①%2足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②%2②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤
液B;
③将滤液B稀释为250mL;
④取稀释液25.00mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL.
请根据以上实验,回答下列问题:
(1)Ⅰ中装置A仪器名称为 ;B仪器名称为 .
(2)Ⅰ中装置C中盛装的试剂是 ;E瓶的作用是 .
(3)Ⅱ中加入过量H2O2溶液发生反应的离子方程式为 .
(4)Ⅲ的步骤③中,将滤液B稀释为250mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;滴定终点的标志是 .
(5)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为 .(用含m1和m2的代数式表示)
-
(16分)某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:
【实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体。
(1)该小组作出此推测的理由是:________。
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2 mol/L的H2C2O4标准溶液、0.1 mol/L的酸性KMnO4标准溶液、酸碱指示剂。
b.实验装置设计及组装(加热及夹持装置均已略去)

【实验过程及数据处理】
(2)B中发生反应的离子方程式为:________。
(3)实验前先通入一段时间的N2,其目的是________。
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是________
________。
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25 mL,用H2C2O4标准溶液进行滴定。
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平。
( )H2C2O4+( )MnO4- +( )H+ =( )Mn2+ +( ) H2O+( ) ( )
②滴定达到终点时的现象是________。
③重复滴定两次,平均每次耗用H2C2O4标准溶液15.63 mL,则铁与浓硫酸反应产生的SO2气体的物质的量为________;经称量,实验前后装置D的质量减少0.9 g,则产生的气体中SO2的体积分数为________。
-
(10分)研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1) I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g) 2I2O5(s) ΔH=-75.56 kJ·mol-1
2I2O5(s) ΔH=-75.56 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH=-566.0 kJ·mol-1
2CO2(g) ΔH=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2) 降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①该反应的化学平衡常数表达式为K= 。
②一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 (填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. N2和CO2的体积比保持不变
d. 每生成1 mol N2的同时生成2 mol NO
③若在一定温度下,将2 mol NO、1 mol CO充入1 L固定容积的容器中, 反应过程中各物质的浓度变化如下图所示。若保持温度不变,20 min时再向 容器中充入CO、N2各0.6 mol,平衡将 (填“向左”、“向右”或“不”)移动。20 min时,若改变反应条件,导致N2浓度发生如右图所示的变化,则改变的条件可能是 (填字母)。a. 加入催化剂 b. 降低温度 c. 增加CO2的量

-
(10分)黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2
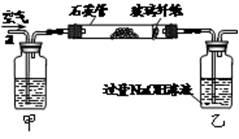
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。

[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。

问题讨论:
(1)上述装置中,甲瓶内所盛试剂是________溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为________。
II中除了可以用H2O2溶液作为氧化剂,还可以加入________(填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为________。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填)________(填“合理“或”不合理“)、________(如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有________。
-
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降落在热电厂附近的雨水进行实验。
① 测得该雨水样品的pH为4.73;② 向雨水样品中滴加BaCl2溶液,有白色沉淀生成;③ 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为_________________________________。
(2)分析上述数据变化,你认为形成这一变化的原因是_____________________。
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算(列出计算过程):
① 该V L雨水中溶解SO2的体积(标准状况)为______________mL。
计算过程:
② 生成沉淀物的质量范围为________________________。计算过程:











