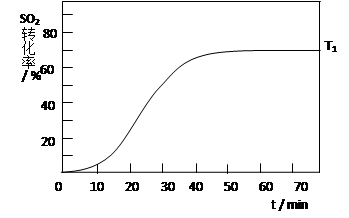-
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
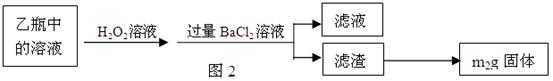
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。
[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示:

问题讨论:
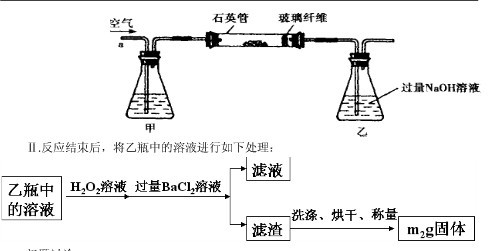
(1)Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有:
________、________。
(2)Ⅱ中的滤渣在称量前还应进行的操作是。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是________。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
写出④中反应的离子方程式________。
(5)该黄铁矿中硫元素的质量分数为________。
-
(10分)黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2
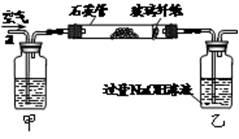
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。

[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。

问题讨论:
(1)上述装置中,甲瓶内所盛试剂是________溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为________。
II中除了可以用H2O2溶液作为氧化剂,还可以加入________(填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为________。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填)________(填“合理“或”不合理“)、________(如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有________。
-
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:______ 2Fe2O3(s)+8SO2(g)△H=-3408kJ/mol
-
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是________。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
(4)反应:2SO2(g)+O2(g) 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
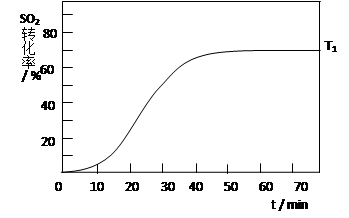
-
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与反应).某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
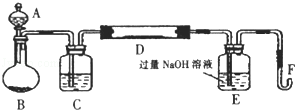
Ⅰ.实验装置如下图所示(夹持和加热装置已省略).A中的试剂是双氧水,将m1g该硫铁矿样品放人硬质玻璃管D中.从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全.
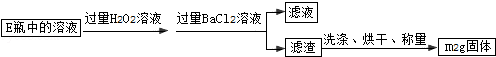
Ⅱ.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
Ⅲ.测定铁元素含量的实验步骤如下:
①%2足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②%2②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤
液B;
③将滤液B稀释为250mL;
④取稀释液25.00mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL.
请根据以上实验,回答下列问题:
(1)Ⅰ中装置A仪器名称为 ;B仪器名称为 .
(2)Ⅰ中装置C中盛装的试剂是 ;E瓶的作用是 .
(3)Ⅱ中加入过量H2O2溶液发生反应的离子方程式为 .
(4)Ⅲ的步骤③中,将滤液B稀释为250mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;滴定终点的标志是 .
(5)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为 .(用含m1和m2的代数式表示)
-
(12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K为 SO2的平衡转化率为 若将0.10molSO2(g)和0.060molO2(g)放入容积为1L的密闭容器中在该温度下达平衡,与前者比较,SO2的平衡转化率 SO2的体积分数 (填增大、减小、不变、无法确定)
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更重要的化工原料,反应的化学方程式为
-
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1) 某温度下,将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2(10分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。

⑴达到平衡所需要的时间:t(A)________t(B),
⑵达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向________反应方向移动,B中的化学反应速率________。
⑶达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量________,B容器中SO2的百分含量________。
-
(12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2 和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
-
(12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
-
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3。
(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:
2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率________、________。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。计算该条件下反应的平衡常数K和SO2的平衡转化率________、________。

(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有________(填字母序号,多选倒扣分)。
A.升高温度 B.降低温度
C.增大压强 D.加入催化剂
E.移出氧气
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。判断:平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”)。