-
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组拟用下列装置定量分析空气中SO2的含量:

(1)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,SO2在该反应中是___________(填“氧化剂”或“还原剂”)。
(2)通入空气前应进行的实验操作是___________。
(3)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为____________g/L。(写出计算过程)
高二化学简答题困难题查看答案及解析
-
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降落在热电厂附近的雨水进行实验。
① 测得该雨水样品的pH为4.73;② 向雨水样品中滴加BaCl2溶液,有白色沉淀生成;③ 每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h
0
1
2
3
4
雨水样品的pH
4.73
4.62
4.56
4.55
4.55
根据以上信息,回答下列问题:
(1)正常雨水的pH为5.6,偏酸性,这是因为_________________________________。
(2)分析上述数据变化,你认为形成这一变化的原因是_____________________。
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算(列出计算过程):
① 该V L雨水中溶解SO2的体积(标准状况)为______________mL。
计算过程:
② 生成沉淀物的质量范围为________________________。计算过程:
高二化学填空题简单题查看答案及解析
-
酸雨是大气污染物之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学取刚降落在热电厂附近的雨水进行实验:
①测得该雨水样品的pH为4.73;
②向雨水样品中滴加BaCl2溶液,有白色沉淀生成;
③每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
根据以上信息,回答下列问题:测定时间/h 1 2 3 4 雨水样品的pH 4.73 4.62 4.56 4.55 4.55
(1)正常雨水的pH为5.6,偏酸性,这是因为______.
(2)分析上述数据变化,你认为形成这一变化的原因是______.
(3)兴趣小组同学取某一时段的这种雨水V L,加入0.5mol•L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗60.00mL Ba(OH)2溶液.
请计算:①该V L雨水中溶解SO2的体积(标准状况)
②生成沉淀物的质量范围(写出计算过程).高二化学解答题中等难度题查看答案及解析
-
SO2 是危害最为严重的大气污染物之一,SO2 的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理 SO2。催化还原 SO2 不仅可以消除 SO2 污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4 可使 SO2 转化为 S,同时生成 CO2 和 H2O。已知 CH4 和 S的燃烧热分别为 890.3 kJ /mol 和 297.2 kJ /mol , CH4 和 SO2 反应的热化学方程式为__________。
(2)用 H2 还原 SO2 生成S 的反应分两步完成,如图 1 所示,该过程中相关物质的物质的量浓度随时间的 变化关系如图 2 所示:
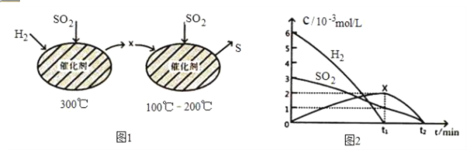
①分析可知X 为______写化学式),0~t1 时间段的温度为_____,0~t1 时间段用SO2 表示的化学反应速率为_____。
②总反应的化学方程式为____________。
高二化学综合题中等难度题查看答案及解析
-
SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4 和S的燃烧热分别为890.3 kJ /mol 和297.2 kJ /mol,CH4和SO2反应的热化学方程式为______________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:
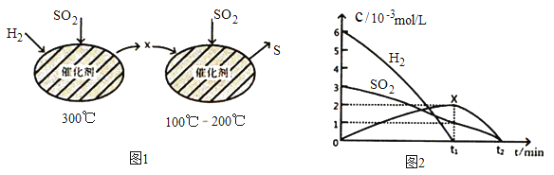
①分析可知X为____________(写化学式),0~t1时间段的温度为_________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,比较Na2SO3 溶液中各离子浓度的大小关系为__________________。
高二化学综合题困难题查看答案及解析
-
SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4 和S的燃烧热分别为890.3 kJ /mol 和297.2 kJ /mol,CH4和SO2反应的热化学方程式为______________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:
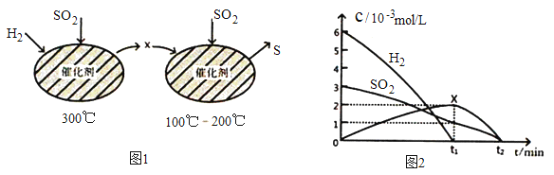
①分析可知X为____________(写化学式),0~t1时间段的温度为_________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,比较Na2SO3 溶液中各离子浓度的大小关系为__________________。
高二化学综合题困难题查看答案及解析
-
某化工厂设计要求为:空气中二氧化硫含量不得超过0.02 mg/L。
某同学拟用下图所示简易装置测定空气中的SO2含量:准确移取10mL 5×10-4 mol/L的标准碘水溶液,注入右图所示试管中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止。假设该同学的测量是准确的,则他抽气的次数至少大于 次时方可说明该厂空气中的SO2含量达标。
高二化学计算题困难题查看答案及解析
-
空气污染监测仪是根据二氧化硫与溴水的定量反应来测定空气中的二氧化硫含量的。
SO 2 +Br 2 +2H 2 O
2HBr+H 2 SO 4
上述反应的溴来自一个装有酸性(H 2 SO 4 )KBr溶液的电解槽阳极上的氧化反应。电解槽的阳极室与阴极室是隔开的。当测定某地区空气中SO 2 含量时,空气(已除尘)以1.5×10 -4 m 3·min -1 的流速进入电解槽的阳极室,电流计显示电子通过的速率是8.56×10 -11 mol·s -1 ,此条件下能保持溴浓度恒定并恰好与SO 2 完全反应(空气中不含能与溴反应的其他杂质)。写出上述材料中监测过程中发生的主要的化学反应方程式及该地区空气中SO 2 的含量(g·m -3 )。
高二化学计算题困难题查看答案及解析
-
(1)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标能体现空气的质量。下列各项指标不需要监测的是___________。
A.可吸入颗粒物(PM2.5) B.NO2浓度 C.SO2浓度 D.CO2浓度
②下列措施有利于改善环境质量的是___________。
A.将废电池深埋,以减少重金属的污染
B.将地沟油回收再加工为食用油,以减缓水体富营养化
C.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
(2)采取适当的措施能减少对环境的污染。
①酸雨是指pH___________的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因___________。
②一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为2C8H18+23O2
12CO2+4CO+18H2O
某环境监测兴趣小组的同学描绘的市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是____________。
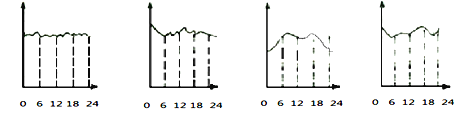
A B C D
③天然水中含有的细小悬浮颗粒可以用___________做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8至9时生成沉淀而除去,该反应的离子方程式是_____________。
(3)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是___________(填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种___________(填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗____________(填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(4)化学与材料密切相关。
①人工合成的塑料有多种,其中聚乙烯是常见的塑料制品,结构简式是___________。
②钢铁的腐蚀主要发生吸氧腐蚀,其正极的电极反应为___________。为防止轮船的船体在海水中被腐蚀,一般在船身连接_____________(填“锌块”或“铜块”)。
高二化学简答题中等难度题查看答案及解析
-
节日期间因燃放鞭炮会引起空气中SO2含量增高.造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量
(1)他们设计如下实验装置,请你参与探究并回答问题
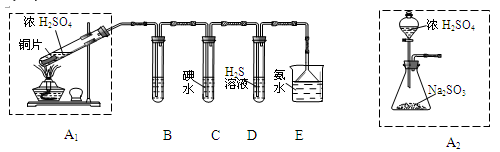
①装置A1中发生反应的化学方程式为________________________。
②装置B用于检验SO2的漂白性,其中所盛试剂为_________,装置D中实验现象为_______________。
③装置C中反应的离子方程式为___________________________________。
④为了实现绿色环保的目标。 甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写两点)________________________________________________________________。
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)
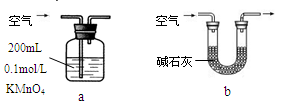
你认为哪个装置可行(填序号)__________,使用你所选用的装置测定SO2含量时,还需要测定的物理量是______________________________;不可行的请说明理由___________________________。
高二化学实验题困难题查看答案及解析