-
Ni2O3是重要的蓄电池材料。一种以油化工中含镍废料(主要成分为NiO和SiO2,含少量Fe2O3·Cr2O3)为原料制备Ni2O3的工业流积如图:
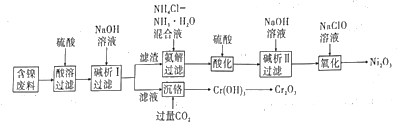
已知:①Cr(OH)3是两性氢氧化物。
②Ni(OH)2溶于NH4Cl-NH3·H2O混合液生成[Ni(NH3)6]2+,F(OH)3不能溶于NH4Cl-NH3·H2O混合液。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答下列问题:
(1)为提高酸剂效率,可采取的措施是__。(任写两种)
(2)“碱析I”时,加入的NaOH溶液需过量,则"沉铬”的离子方程式为__。
(3)“氨解”的目的为_。
(4)“酸化"时发生反应的离子方程式为__。“氧化”时发生反应的化学方程式为__。
(5)实验室灼烧Cr(OH)3转化为Cr2O3,现有酒精灯、三脚架,还缺少的仪器为__。
(6)“碱析II”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于___。[已知Ni(OH)2的Ksp=2×10-15, 1.4]
1.4]
-
NiSO4是制备磁性材料和催化剂的重要中间体。用含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)制备NiSO4并回收金属资源的流程如图:
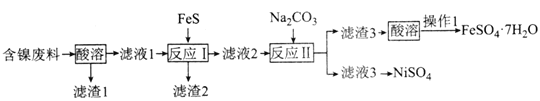
下列说法错误的是( )
A.“酸溶”时应选用硫酸
B.滤渣2的成分为CuS和FeS
C.“操作1”为蒸发结晶
D.合理处理废弃物有利于保护环境和资源再利用
-
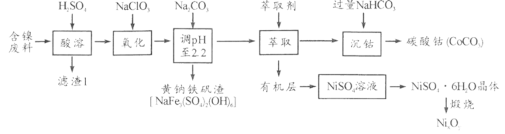
以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2等)为原料制备NixOy和碳酸钻的工艺流程如下:
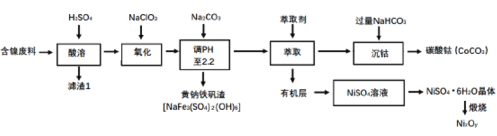
(1)“酸溶”时需将含镍废料粉碎,目的是___;含有CoCO3的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为____。
(2)“氧化”中添加NaClO3的作用是____,为证明添加NaClO3已足量,可用____ (写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀(NaFe3(SO4)2(OH)6),其离子方程式为_____。
(4)“沉钴”过程的离子方程式__。若“沉钴钻”开始时c(Co2+)=0.10 mol/L,则控制pH≤__时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)。
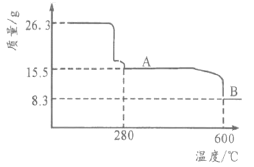
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,_____,过滤,洗涤,干燥。“锻烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物(NixOy)的化学式为____。
-
以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:
(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________;“滤渣Ⅰ”主要成分为____________________(填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________,为证明添加NaClO3已足量,可用_______________(写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________。
(4)“沉钴”过程的离子方程式________________________。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
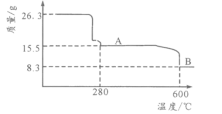
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________。
-
以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:

(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________;“滤渣Ⅰ”主要成分为____________________(填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________,为证明添加NaClO3已足量,可用_______________(写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________。
(4)“沉钴”过程的离子方程式________________________。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
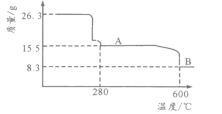
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________。
-
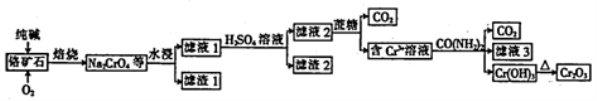
Cr2O3是重要的化工原料。铬矿石的主要成分为Cr2O3,并含有一定量的FeO、SiO2等杂质,工业上生产Cr2O3的过程如图所示。

回答下列问题:
(1) 焙烧后的产物Na2CrO4中Cr的化合价为_____。
(2)滤液1用H2SO4酸化时发生反应的离子方程式为2CrCO42-+2H+=Cr2O72-+ H2O和_______,该过程不能用盐酸代替硫酸的理由是_______________。
(3)向滤液2中加蔗糖的目的是_________,滤液3中溶质的主要成分为_____(填化学式)。
(4)若向滤液2的饱和溶液中加入KCl固体,充分反应后可得货要的试剂K2Cr2O7。该反应能发生的原因是____________________。
-
Cr2O3是重要的化工原料。铬矿石的主要成分为Cr2O3,并含有一定量的FeO、SiO2等杂质,工业上生产Cr2O3的过程如图所示。
回答下列问题:
(1) 焙烧后的产物Na2CrO4中Cr的化合价为_____。
(2)滤液1用H2SO4酸化时发生反应的离子方程式为2CrCO42-+2H+=Cr2O72-+ H2O和_______,该过程不能用盐酸代替硫酸的理由是_______________。
(3)向滤液2中加蔗糖的目的是_________,滤液3中溶质的主要成分为_____(填化学式)。
(4)若向滤液2的饱和溶液中加入KCl固体,充分反应后可得货要的试剂K2Cr2O7。该反应能发生的原因是____________________。
-
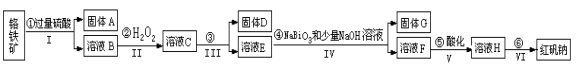
Ⅰ.某化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3 ,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7 ·2H2O),其主要工艺流程如下图:
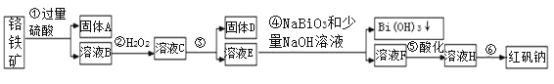
查阅资料得知:
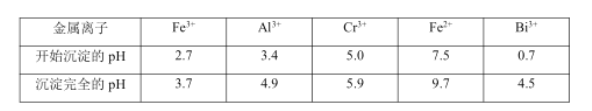
i.常温下,NaBiO3 不溶于水,有强氧化性,在碱性条件下,能将 Cr 3+ 转化为CrO42- 。
ii.
回答下列问题:
(1)步骤③加的试剂为氢氧化钠溶液,此时溶液 pH 要调到5的目的是_________ 。
(2)写出④反应的离子反应方程式:________________
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是____________ (填操作名称)。
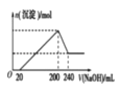
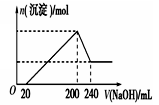
(4)取一定质量的固体 D 溶解于 200mL 的硫酸中,向所得溶液中加入5mol/L 的NaOH 溶液,生成沉淀的物质的量n与加入NaOH 溶液的体积V 关系如图所示,则硫酸的浓度为_______ ,固体 D 中含铁化合物的物质的量为__________ 。
Ⅱ.经检测该化工厂的工业废水中含 5.00×10 -3 mol·L -1 的 Cr2O72- ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4 (Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
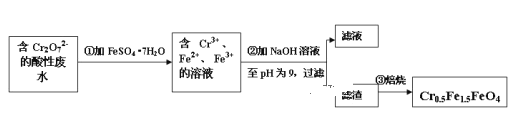
(1)第①步反应的离子方程式_______________ 。
(2)欲使 1L 该废水中的 Cr2O72- 完全转化为 Cr 0.5 Fe 1.5 FeO4 。理论上需要加FeSO4 ·7H2O 的质量为 ________g (已知 FeSO 4 ·7H2O 的摩尔质量为 278g/mol)。
-
(14分)以铬铁矿(主要成分为FeO和Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(红矾钠的主要成分为重铬酸钠:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅资料得知:
i. 常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
| 物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是 。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和__________(填仪器名称)。
(3)写出④反应的离子反应方程式 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式 。
(5)将溶液H经过下列操作,蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为 ,固体D中含Fe化合物的物质的量为 。
-
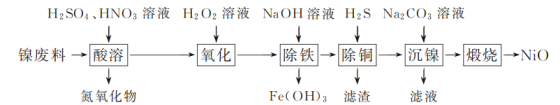
以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。

1.4]















