-
氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。
I.(1)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+ 8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl21.5mol,则被氧化的NH3在标准状况下的体积为__________L,该过程中电子转移的总数为__________________ 个。
(2)黄绿色气体ClO2(其中氯元素价态为+4)可用于污水杀菌和饮用水净化。ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中还原剂与氧化剂的物质的量之比为________。
II.实验室可用如下装置制备氯气并验证氯气的性质置(其中夹持装置已省略)。

已知:装置A是氯气的发生装置,反应的化学方程式为Ca(ClO)2 + 4HCl(浓)═ CaCl2+2Cl2↑+2H2O据此回答下列问题:
(1)装置B中饱和食盐水的作用是_______。
(2)装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是:湿润的有色布条、无水氯化钙、干燥的有色布条,请你推测Ⅲ处的现象为:__________。
(3)装置D的作用是___________,则烧杯中的溶液是__________,写出所发生反应的化学方程式_____________________________ 。
-
氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。
(1)NaClO中Cl的化合价为____,有较强的___(填氧化、还原)性。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2 ,SO2被氧化为SO42-,此反应的离子方程式为____。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为____。
-
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用氯气.
I.工业上通常采用电解法制氯气:观察图1,回答:
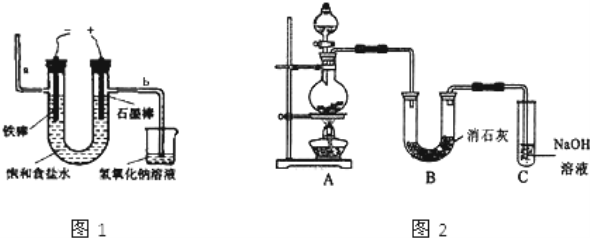
(1)电解反应的化学方程式为 .
(2)若饱和食盐水中通电后,b侧产生的气体检验方法是 。
Ⅱ.某学生设计如图2所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式 ;若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 mol.
(2)漂白粉将在U形管中产生,其化学方程式是 .
(3)C装置的作用是
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应.①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。②试判断另一个副反应(用化学方程式表示) 。
为避免此副反应的发生,可将装置做何改进 。
-
(15分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示)▲ 。
某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
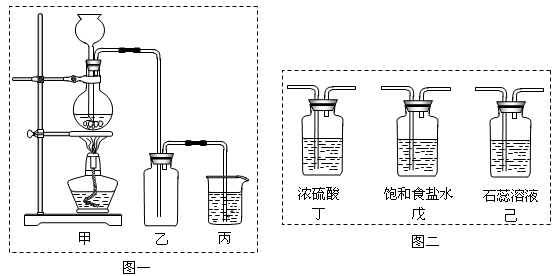
(1)指出图一装置中的错误之处▲ ,▲
(2)丙装置的作用▲ 。丙装置中发生反应的离子方程式▲ 。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序:▲ 。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
▲ 。
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
▲ 。为什么?▲ 。
-
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:

(1)通电后,_____(填“铁棒”或“石墨棒”)电极上产生氯气,若饱和食盐水中含有酚酞,______(填“a”或“b”)侧先变红。
(2)写出该电解反应的化学方程式为_______________________________________。
(3)该装置中,NaOH溶液的作用是____________________________。
II.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
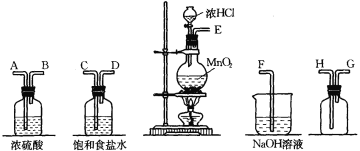
(1)连接上述仪器的正确顺序是:E→_______→________→_______→_______→H→G→F。
(2)气体发生装置中进行的反应化学方程式是________________________________;若在标准状态下收集到4.48 L氯气,则被氧化的HCl的物质的量是_______mol。
(3)上面装置中饱和食盐水的作用是__________________。
(4)将新制氯水滴到pH试纸上,现象为_________________________________。
-
(20分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气:观察下图,回答:

Ⅰ(1)若饱和食盐水中含有酚酞,通电后_____(填a或b)侧先变红。
(2)电解反应的化学方程式为__________________
Ⅱ某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为________,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是________。
(2) 漂白粉将在U形管中产生,其化学方程式是________。
(3) C装置的作用是________________。
(4) 此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②试判断另一个副反应(用化学方程式表示)________。为避免此副反应的发生,可将装置作何改进________________。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是________________。
A.食盐 B.食醋 C.烧碱 D.纯碱
-
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。


图一
(1)指出图一装置中的错误之处
(2)C装置中发生反应的离子方程式。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序(可不选全):。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是________。
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“B”换成“F”,你认为他这样做对吗?
。为什么?。
-
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:
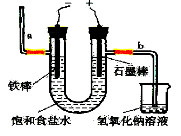
(1)若饱和食盐水中含有酚酞,通电后______(填a或b)侧先变红。
(2)电解反应的化学方程式为___________________________。
(3)漂白粉长期露置在空气中失效,请写出相关氧化还原反应的一条化学方程式____________________。
II.下图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去)。请根据要求完成下列各题。

(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应。所选装置的顺序依次为(从左向右) ;
(2)写出A中反应的离子方程式并用双线桥法表示反应中电子转移的方向和数目_________________;若在标准状态下收集到2.24 L氯气,则被氧化的HCl的物质的量是____________mol。
(3)E管中现象___________________________;脱脂棉的作用是____________________。
-
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:
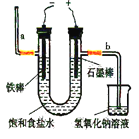
(1)若饱和食盐水中含有酚酞,通电后_____(填a或b)侧先变红。
(2)电解反应的化学方程式为_______________________。
II. 某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
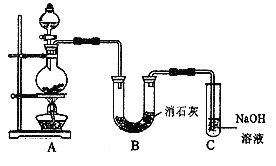
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为_________________________________________
(2)漂白粉将在U形管中产生,其化学方程式是__________________________________。
(3)C装置的作用是_____________________。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是_________________________________。
②试判断另一个副反应(用化学方程式表示)_______________________________________。为避免此副反应的发生,可将装置作何改进_____________________________________。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是______________。
A.食盐 B.食醋 C.烧碱 D.纯碱
-
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
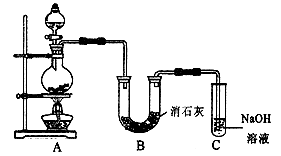
(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,若在标准状态下收集到22.4升的氯气,则被氧化的HCl的物质的量是 。
(2)漂白粉将在U形管中产生,其化学方程式是 。
(3)C装置的作用是 。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3) 2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(用化学方程式表示) 。为避免此副反应的发生,可将装置作何改进 。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 。
A.食盐 B.食醋 C.烧碱 D.纯碱













