-
(1)甲醇 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和 在一定条件下制备
在一定条件下制备 的反应为:
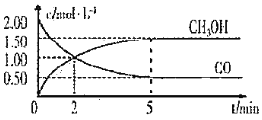
的反应为: ,在体积为1L的恒容密闭容器中,充入
,在体积为1L的恒容密闭容器中,充入 和
和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
①从反应开始至达到平衡,用氢气表示的平均反应速率 ______
______ 。
。
②下列说法正确的是______ 填字母序号
填字母序号 。
。
A.达到平衡时,CO的转化率为
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前 正
正 逆
逆 ,2min后
,2min后 正
正 逆
逆
③该条件下反应的平衡常数 ______。
______。
(2)已知:Ⅰ 的燃烧热为
的燃烧热为
Ⅱ


Ⅲ.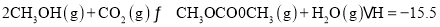

则①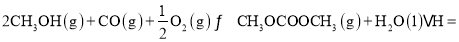 ______。
______。
②对于可逆反应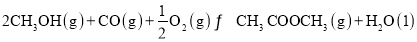 采取以下措施可以提高
采取以下措施可以提高 产率的是______
产率的是______ 填字母
填字母
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为: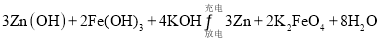 ,则充电时的阳极反应式为______。
,则充电时的阳极反应式为______。
(4)若往 的弱酸
的弱酸 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______ 填序号
填序号 。
。
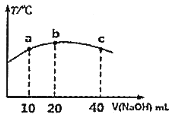
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③ 的电离平衡常数:b点>a点
的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:
-
甲醇 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和 在一定条件下制备
在一定条件下制备 的反应为:
的反应为: ,在体积为1L的恒容密闭容器中,充人
,在体积为1L的恒容密闭容器中,充人 和
和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
 从反应开始至达到平衡,用氢气表示的平均反应速率
从反应开始至达到平衡,用氢气表示的平均反应速率 ______
______
 下列说法正确的是______
下列说法正确的是______ 填字母序号
填字母序号 。
。
A.达到平衡时,CO的转化率为
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前 正
正 逆
逆 ,2min后
,2min后 正
正 逆
逆
 该条件下反应的平衡常数
该条件下反应的平衡常数 ______。
______。
-
(1)甲醇 是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备
是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备 的反应:
的反应: ,在体积为1L的恒容密闭容器中,充2molCO和
,在体积为1L的恒容密闭容器中,充2molCO和 ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
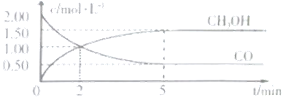
①从反应开始到5min,用一氧化碳表示的平均反应速率υ(CO)=______。
②下列说法正确的是______。
A.达到平衡时, 的转化率为
的转化率为
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氨气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
(2)一定温度下,将 与
与 以体积比1:2置于密闭容器中发生反应:
以体积比1:2置于密闭容器中发生反应:
 ,达到平衡时
,达到平衡时 的体积分数为
的体积分数为 ,该反应的平衡常数
,该反应的平衡常数 ______。
______。
(3)碳与水蒸气反应制取 的相关反应如下:
的相关反应如下:
Ⅰ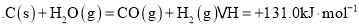
Ⅱ
Ⅲ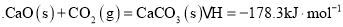
①计算反应 的
的 ______
______
②对于可逆反应 ,采取以下措施可以提高
,采取以下措施可以提高 产率的是______。
产率的是______。
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(4)以甲醇为燃料, 为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
为氧化剂,KOH溶液为电解质溶液,可制成燃料电池 电极材料为惰性电极
电极材料为惰性电极 。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
(5)若往20mL  的弱酸
的弱酸 溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______
①该烧碱溶液的浓度为
②该烧碱溶液的浓度为
③ 的电离平衡常数:b点
的电离平衡常数:b点 点
点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
-
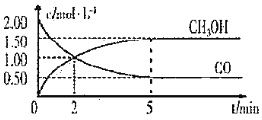
(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
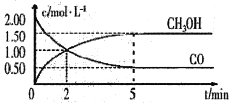
①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+ O2(g)
O2(g) CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+  O2(g)
O2(g) CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
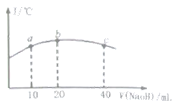
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。
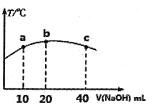
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
-
(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
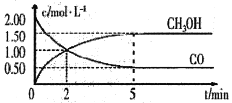
①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+ O2(g)
O2(g) CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+  O2(g)
O2(g) CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。
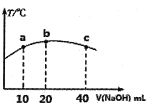
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
-
(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
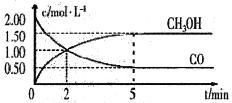
①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+ O2(g)
O2(g) CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+  O2(g)
O2(g) CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。
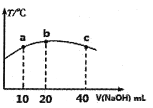
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
-
甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为CO(g)+2H2(g) CH3OH(g); △H。
CH3OH(g); △H。
(1)在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间的变化如图甲所示。
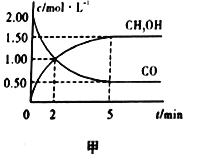
①从反应开始到5min,用氢气表示的平均反应速率v(H2)=________。
②下列说法正确的是________(填序号)。
A. 达到平衡时,H2的转化率为75%
B. 5min后容器中压强不再改变
C. 达到平衡后,再充入氩气,反应速率增大
D. 2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)某温度下,在一恒压容器中分别充入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数的值为__________。
(3)甲醇是一种新型的汽车动力燃料。已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________。
(4)现有容积均为1L的a、b、c三个密闭容器,往其中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b中甲醇体积分数大于a中的原因是____________。达到平衡时,a、b、c中CO的转化率大小关系为___________。
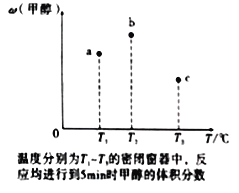
(5)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为___________________________。
-
甲醇(CH3OH)重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
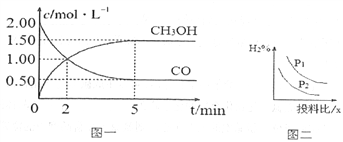
①反应2min到5min,用氢气表示的平均反应速率v(H2)=_____________。
②下列说法正确的是_____________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是__________(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆 D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3mo1CH3OH(g),则此平衡将______________(填“向正反应方向”、“不”或“向逆反应方向”)移动。
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,已知:CH3OH、H2的燃烧热(△H)分別为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是__________________________。
-
(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g) CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
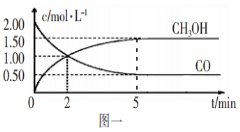
①从反应开始到l0min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________。
-
甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为CO(g)+2H2(g) CH3OH(g) △H。
CH3OH(g) △H。
(1)在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间的变化如下图甲所示。
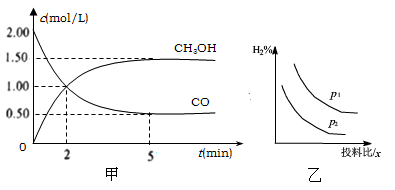
①从反应开始到5min,用氢气表示的平均反应速率v(H2)=________。
②下列说法正确的是________(填序号)。
A. 达到平衡时,H2的转化率为75%
B. 5min后容器中压强不再改变
C. 达到平衡后,再充入氩气,反应速率增大
D. 2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)某温度下,在一恒压容器中分别充入1.2molCO和1molH2,达到平衡时容器体积为2L,且含有0.4molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.35molCO气体,则此平衡将___(填“正向移动”“不移动”或“逆向移动”)
(3)若压强、投料比x [n(CO)/n(H2)]对反应的影响如图乙所示,则图中曲线所示的压强关系:p1___p2(填“=”“>”或“<”),其判断理由是__________。
(4)甲醇是一种新型的汽车动力燃料。已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____。
(5)现有容积均为1L的a、b、c三个密闭容器,往其中分别充入1molCO和2molH2的混合气体,控制温度,进行反应,测得相关数据的关系如下图所示。b中甲醇体积分数大于a中的原因是_____。达到平衡时,a、b、c中CO的转化率大小关系为___________。
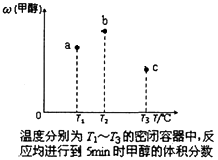
(6)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为____。
是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备
的反应:
,在体积为1L的恒容密闭容器中,充2molCO和
,一定条件下发生上述反应,测得
和
的浓度随时间变化如图所示。

的转化率为
与
以体积比1:2置于密闭容器中发生反应:
,达到平衡时
的体积分数为
,该反应的平衡常数
______。
的相关反应如下:
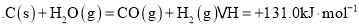
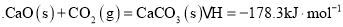
的
______
,采取以下措施可以提高
产率的是______。
为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
电极材料为惰性电极
。若KOH溶液足量,写出此燃料电池负极的电极反应式:______;
的弱酸
溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是______

的电离平衡常数:b点
点

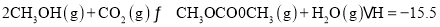
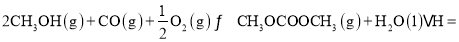 ______。
______。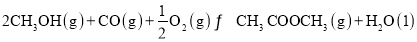 采取以下措施可以提高
采取以下措施可以提高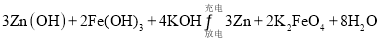 ,则充电时的阳极反应式为______。
,则充电时的阳极反应式为______。












