-
氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
(1)①已知4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) △H=-1200kJ⋅mol-1。对于该反应,改变某一反应条件,(已知温度T2>T1)下列图象如图1正确的是___(填代号)。
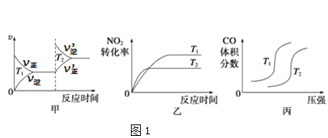
②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-QkJ⋅mol-1。820℃时,在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为___;乙容器吸收的热量为___。
| 甲 | 乙 |
| 0.10molH2O | 0.20molH2 |
| 0.10molCO | 0.20molCO2 |
(2)氨水常用作沉淀剂,已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Al(OH)3]=1.1×10-33,向浓度均为0.1mol⋅L-1的FeCl3和AlCl3混合溶液中加入氨水,首先生成的沉淀是___(填化学式)。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
①N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ⋅mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ⋅mol-1
写出肼与四氧化二氮反应的热化学方程式___。
(4)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL0.1mol⋅L-1NaOH溶液中加入0.2mol⋅L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图2。
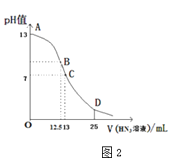
①根据图象写出HN3的电离方程式:___。
②下列说法正确的是___(填序号)。
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2mol⋅L-1HN3的溶液中加水稀释,则 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1mol⋅L-1NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+)+c(HN3)=c(N3-)+2c(OH-)
-
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)已知NA表示阿伏加德罗常数,在69g NO2和N2O4的混合气体中含有____NA个氧原子;在2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
①写出该反应的化学方程式 .若反应中生成0.15 mol HNO3,则该反应中转移的电子数目为 个。
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3, F2, NO这三种气体中,氧化性由强到弱的顺序为 。
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
-
4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1200kJ·mol-1,已知T2>T1,对于该反应,下列图象正确的是
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1,已知T2>T1,对于该反应,下列图象正确的是
A. B.
B.
C.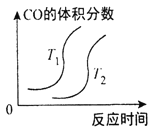 D.
D.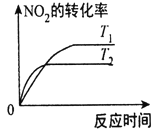
-
硫是中学化学重要的非金属元素之一,请回答下列有关问题。
已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol
2NO(g)+O2(g) 2NO2(g) △H=-113.0kJ/mol
2NO2(g) △H=-113.0kJ/mol
(1)反应NO2(g)+ SO2(g) SO3(g)+NO(g)的ΔH= ______kJ/mol 。
SO3(g)+NO(g)的ΔH= ______kJ/mol 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 _________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时消耗1 molNO
(3)S2Cl2和SCl2均为重要的工业化合物。已知:
a.S2(l)+Cl2(g) S2Cl2(g) △H1
S2Cl2(g) △H1
b.S2Cl2(g)+ Cl2(g) 2SCl2(g) △H2
2SCl2(g) △H2
—定压强下,向10 L密闭容器中充入1 molS2Cl2和1 mol Cl2,发生反应b。Cl2与SCl2的消耗速率(υ)与温度(T)的关系如图所示:
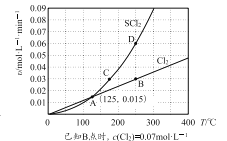
① A、B、C、D四点对应状态下,达到平衡状态的有______(填字母),理由是_______。
②—定温度下,在恒容密闭容器中发生反应a和反应b,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率_________(填“增大”或“减小”或“不变”),理由是________。
II.氮有不同价态的化合物,如氨、氮气、亚硝酸钠、乙二胺等。
图(I)和图(II)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。
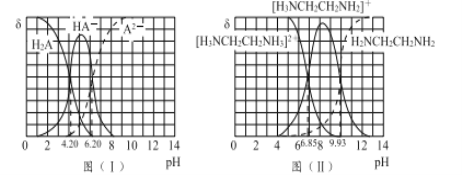
(1)H3NCH2CH2NH3A溶液显____(填“酸”或“碱”)性。
(2)乙二胺在水溶液中发生第二步电离的方程式:____________________,其平衡常数Kb2= _______________________ 。
(3)向20 mL 0.1 mol/L的H2A溶液加入10 mL 0.1 mol/L H2NCH2CH2NH2溶液后,溶液中各离子浓度大小的关系为 ____________________________________。
-
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1) 表示阿伏加德罗常数的数值,69g
表示阿伏加德罗常数的数值,69g 和
和 的混合气体中含有__________个氧原子;2L 0.6 mol/L
的混合气体中含有__________个氧原子;2L 0.6 mol/L 溶液中含_________个
溶液中含_________个 离子。
离子。
(2)三氟化氮( )是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: 、
、 和
和 ,
,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol  ,转移的电子数目为________个.
,转移的电子数目为________个.
② 三氟化氮可由氨气和氟气反应得到: ;据题意推测
;据题意推测 ,
, ,
, 三种气体中,氧化性由强到弱的顺序为____________________
三种气体中,氧化性由强到弱的顺序为____________________
③ 是一种无色、无臭的气体,一旦
是一种无色、无臭的气体,一旦 泄漏,可以用
泄漏,可以用 溶液喷淋的方法减少污染,其产物除
溶液喷淋的方法减少污染,其产物除 、
、 、
、 外,还肯定有_____________(填化学式).
外,还肯定有_____________(填化学式).
(3)氨和联氨( )是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
-
(14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答 下列问题:
下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol HNO3,转移的电子数目为________个.
② 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3、F2、NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有_______________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
-
12分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答 下列问题:
下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
①写出该反应的化学方程式 .
若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为 。
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
-
(本题共14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .若反应中生成0.15 mol HNO3,转移的电子数目为________个.
② 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有__________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
-
(14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答 下列问题:
下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol HNO3,转移的电子数目为________个.
② 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3、F2、NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有_______________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
-
14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答 下列问题:
下列问题:
(1)NA表 示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____________NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含________NA个NO3-离子。
示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____________NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含________NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
①写出该反应的化学方程式 若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测NF3、F2、NO三种气体中,氧化性由强到弱的顺序为________________________
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有___________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催 化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。


不变
 B.
B.
 D.
D.

