-
硫是中学化学重要的非金属元素之一,请回答下列有关问题。
已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ/mol
2SO3(g) △H=-196.6kJ/mol
2NO(g)+O2(g) 2NO2(g) △H=-113.0kJ/mol
2NO2(g) △H=-113.0kJ/mol
(1)反应NO2(g)+ SO2(g) SO3(g)+NO(g)的ΔH= ______kJ/mol 。
SO3(g)+NO(g)的ΔH= ______kJ/mol 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 _________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时消耗1 molNO
(3)S2Cl2和SCl2均为重要的工业化合物。已知:
a.S2(l)+Cl2(g) S2Cl2(g) △H1
S2Cl2(g) △H1
b.S2Cl2(g)+ Cl2(g) 2SCl2(g) △H2
2SCl2(g) △H2
—定压强下,向10 L密闭容器中充入1 molS2Cl2和1 mol Cl2,发生反应b。Cl2与SCl2的消耗速率(υ)与温度(T)的关系如图所示:
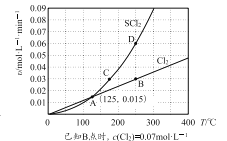
① A、B、C、D四点对应状态下,达到平衡状态的有______(填字母),理由是_______。
②—定温度下,在恒容密闭容器中发生反应a和反应b,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率_________(填“增大”或“减小”或“不变”),理由是________。
II.氮有不同价态的化合物,如氨、氮气、亚硝酸钠、乙二胺等。
图(I)和图(II)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。
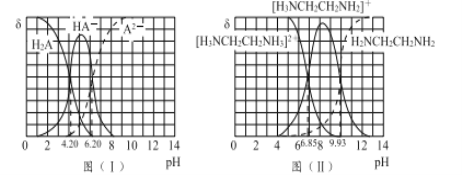
(1)H3NCH2CH2NH3A溶液显____(填“酸”或“碱”)性。
(2)乙二胺在水溶液中发生第二步电离的方程式:____________________,其平衡常数Kb2= _______________________ 。
(3)向20 mL 0.1 mol/L的H2A溶液加入10 mL 0.1 mol/L H2NCH2CH2NH2溶液后,溶液中各离子浓度大小的关系为 ____________________________________。
-
用化学反应原理研究N、S氧化物有着重要的意义。
(1)已知:
2SO2(g)+O2(g)  2SO3(g)ΔH1=-196.6kJ/mol
2SO3(g)ΔH1=-196.6kJ/mol
2NO(g)+O2(g)  2NO2(g)ΔH2=-113.8kJ/mol
2NO2(g)ΔH2=-113.8kJ/mol
NO2(g)+SO2(g) SO3(g)+NO(g)ΔH3
SO3(g)+NO(g)ΔH3
则ΔH3=________,如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=________(用K1、K2表示)。
(2)如下图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2 mol NO和1 mol O2通过K1、K3分别充入A、B中,发生的反应为2NO(g)+O2(g) 2NO2(g)[不考虑2NO2(g)
2NO2(g)[不考虑2NO2(g) N2O4(g)],起始时A、B的体积相同均为a L。
N2O4(g)],起始时A、B的体积相同均为a L。
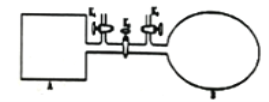
①下列说法和示意图能说明A、B容器均达到平衡状态的是________。
a.A、B容器中气体的颜色均不发生变化
b.A、B容器中NO和O2物质的量浓度比均为2∶1
c.A、B容器中气体的密度不在发生变化
d.A、B容器中气体的平均摩尔质量不再发生变化
e.
②T ℃时,A容器中反应达到平衡时的平衡常数Kp=0.27(kPa)-1。若A容器中反应达到平衡时p(NO2)=200 kPa,则平衡时NO的转化率为________。(Kp是用平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2 L的密闭容器中,测得SO2的物质的量随时间变化如下图实线所示。
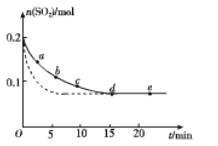
①ab段平均反应速率______________(填“大于”“小于”或“等于”)bc段平均反应速率;de段平均反应速率为________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如上图中虚线所示,则改变的条件是________。
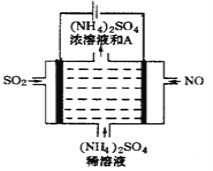
③如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。阴极的电极反应式是_______________。
-
雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol−1
2SO3(g) ΔH=−196.6 kJ·mol−1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol−1
2NO2(g) ΔH=−113.0 kJ·mol−1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)ΔH= kJ·mol−1。
SO3(g)+NO(g)ΔH= kJ·mol−1。
一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有 。
A.体系密度保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶5,则平衡常数K= 。
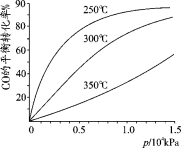
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
(3)如图是一种用NH3脱除烟气中NO的原理。
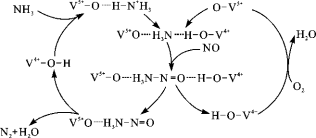
①该脱硝原理中,NO最终转化为H2O和 (填化学式)。
②当消耗1 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为 L。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式 。
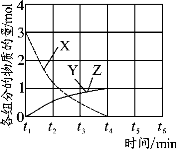
-
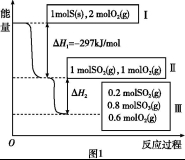
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.
(已知:2SO2 (g)+O2(g) 2SO3(g) △H=-196.6 KJ·mol- 1)
2SO3(g) △H=-196.6 KJ·mol- 1)
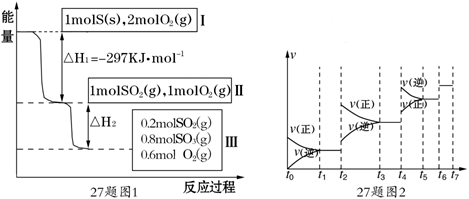
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:________.
(2)ΔH2 =________
(3)恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值比∣ΔH2 ∣________(填“大”、“小”或 “相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为________,若溶液中发生了氧化还原反应,则该过程的离子方程式为________.
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有________.
a.升高温度;
b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g)
d.使用催化剂
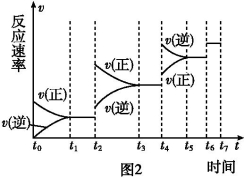
(6)某SO2 (g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是________;图中表示平衡混合物中SO3的含量最高的一段时间是________.
与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是________;图中表示平衡混合物中SO3的含量最高的一段时间是________.
-
Ⅰ.恒温,容积为1 L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
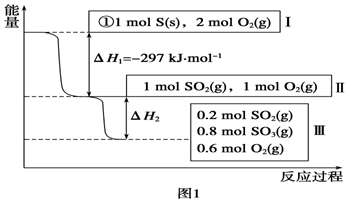
(1)写出能表示硫的燃烧热的热化学方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)  CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118 ℃、78 ℃和77 ℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
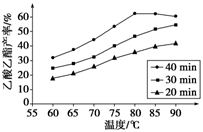
(1)该研究小组的实验目的是___________________________________。
(2)60 ℃下反应40 min与70 ℃下反应20 min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40 min、温度超过80 ℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题:
(1)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
n(CO) n(H2O) n(H2) n(CO2)
A 1 5 2 3
B 2 2 1 1
C 3 3 0 0
D 0.5 2 1 1
E 3 1 2 1
(2)已知在一定温度下,C(s)+CO2(g)  2CO(g)平衡常数为K;
2CO(g)平衡常数为K;
①C(s)+H2O(g)  CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2(g) 平衡常数为K1;
②CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数为K2;
H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是______________________________________。
-
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.(已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6KJ•mol- 1)
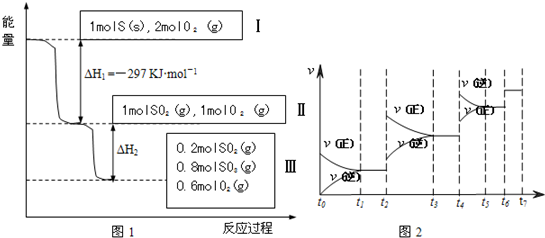
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:______.
(2)△H2=______KJ•mol-1
(3)恒温恒容时,1molSO2和2molO2 充分反应,放出热量的数值比|△H2|______(填“大”“小”或“相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为______.
(5)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______.
a.升高温度; b.充入He气
c.再充入1molSO2(g)和1molO2 (g) d.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______.
-
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.(已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6KJ•mol- 1)
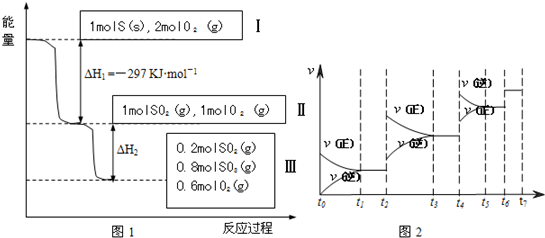
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:______.
(2)△H2=______KJ•mol-1
(3)恒温恒容时,1molSO2和2molO2 充分反应,放出热量的数值比|△H2|______(填“大”“小”或“相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为______.
(5)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______.
a.升高温度; b.充入He气
c.再充入1molSO2(g)和1molO2 (g) d.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______.
-
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示:[已知:2SO2(g)+O2(g)  2SO3(g);△H=-196.9kJ/mol]
2SO3(g);△H=-196.9kJ/mol]
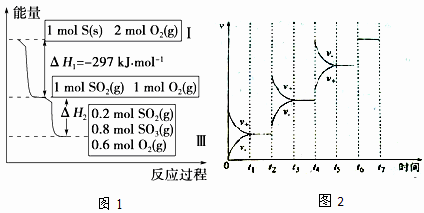
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:_______________________;△H2=_______________;
(2)恒温恒容时,1mol SO2和2mol O2充分反应,放出热量的数值比|△H2|______(填 “大”、“小”或“相等”).
(3)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______。
a.升高温度 b.充入He气 c.再充入1mol SO2(g)和1mol O2(g) d.使用催化剂
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______。
(5)含硫废弃的脱硫减排是减少大气中含硫化合物污染的关键,工业脱除废气中SO2的原理如下:
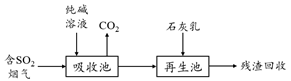
①用纯碱溶液吸收SO2,将其转化为HSO3-,该反应的离子方程式为___________________________;
②若石灰乳过量,将其产物再导入吸收池,其中可用于吸收SO2的物质的电子式是____________。
-
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为: 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
-
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-196.6 kJ/mol。

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
a.升高温度
b.充入He气
c.再充入1 mol SO2(g)和1 mol O2(g)
d.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
2SO3(g) △H=-196.6kJ/mol
2NO2(g) △H=-113.0kJ/mol
SO3(g)+NO(g)的ΔH= ______kJ/mol 。
S2Cl2(g) △H1
2SCl2(g) △H2



















