-
(16分)某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵。
已知盐的热分解温度: NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3 >850℃
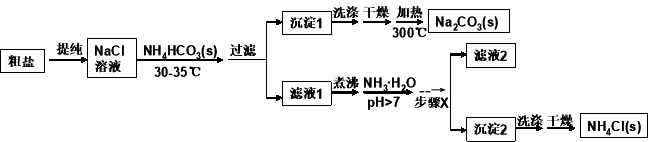
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:①NaOH ②BaCl2 ③HCl ④Na2CO3,其加入的顺序合理的是
A.①③④② B.①②④③ C.③②④① D.①②③④
过滤中用到玻璃棒的作用是 ;
(2)如何判断粗盐中SO42-是否已除尽? ;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩。在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是 ;
(4)写出沉淀1受热分解的化学方程式 ;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是 ;
步骤X包括的操作有 ;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液。从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL。则该样品中氯化铵的质量分数为 。
-
某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱(Na2CO3)和氯化铵(NH4Cl)。
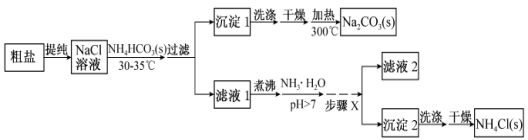
已知盐的热分解温度:NH4HCO3 36℃;NaHCO3 270℃;NH4Cl 340℃;Na2CO3>850℃
请回答:
(1)从NaCl溶液到沉淀1的过程中,需蒸发浓缩。在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3固体之后,其原因是 。
(2)为提高NH4Cl产品的产率和纯度,需在滤液1中加入氨水,理由是 ;步骤X包括的操作有 。
(3)测定NH4Cl产品的纯度时,可采用的方法:在NH4Cl溶液中加入甲醛使之生成游离酸(4NH4Cl+6HCHO=(CH2)6N4+4HCl+6H2O),然后以酚酞为指示剂,用NaOH标准溶液(需用邻苯二甲酸氢钾基准物标定)进行滴定。
①下列有关说法正确的是
A.为了减少滴定误差,滴定管、锥形瓶均须用待装液润洗
B.标准NaOH溶液可以装入带有耐腐蚀旋塞的玻璃滴定管中
C.开始滴定前,不需擦去滴定管尖悬挂的液滴
D.三次平行测定时,每次需将滴定管中的液面调至“0”刻度或“0”刻度以下的附近位置
②若用来标定NaOH标准溶液的邻苯二甲酸氢钾基准物使用前未烘至恒重,则测得NH4Cl产品的含量比实际含量 (填“偏大”、“偏小”或“无影响”)。
-
(10分)某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱(Na2CO3)和氯化铵(NH4Cl)。
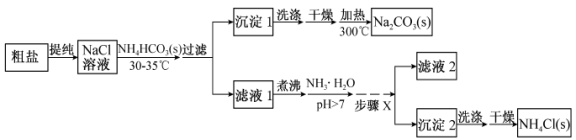
已知盐的热分解温度:NH4HCO3 36℃;NaHCO3 270℃;NH4Cl 340℃;Na2CO3>850℃
请回答:
(1)从NaCl溶液到沉淀1的过程中,需蒸发浓缩。在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3固体之后,其原因是 。
(2)为提高NH4Cl产品的产率和纯度,需在滤液1中加入氨水,理由是 ;步骤X包括的操作有 。
(3)测定NH4Cl产品的纯度时,可采用的方法:在NH4Cl溶液中加入甲醛使之生成游离酸(4NH4Cl+6HCHO=(CH2)6N4+4HCl+6H2O),然后以酚酞为指示剂,用NaOH标准溶液(需用邻苯二甲酸氢钾基准物标定)进行滴定。
①下列有关说法正确的是 。
A.为了减少滴定误差,滴定管、锥形瓶均须用待装液润洗
B.标准NaOH溶液可以装入带有耐腐蚀旋塞的玻璃滴定管中
C.开始滴定前,不需擦去滴定管尖悬挂的液滴
D.三次平行测定时,每次需将滴定管中的液面调至“0”刻度或“0”刻度以下的附近位置
②若用来标定NaOH标准溶液的邻苯二甲酸氢钾基准物使用前未烘至恒重,则测得NH4Cl产品的含量比实际含量 (填“偏大”、“偏小”或“无影响”)。
-
某研究小组以粗盐和碳酸氢铵( )为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为
)为原料,采用如图所示流程制备纯碱和氯化铵。已知盐的热分解温度分别为 ;
; ;
; ;
; 。
。
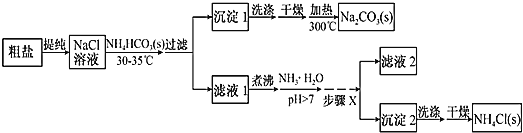
(1)粗盐中主要含有 、
、 、
、 等杂质离子,粗盐提纯时使用的试剂有;①
等杂质离子,粗盐提纯时使用的试剂有;① ;②
;② ;③
;③ ;④
;④ ,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
,其加入的顺序合理的是__________(填序号)。过滤中用到玻璃棒的作用是________。
A.①③④② B.①②④③ C.③②④① D.①②③④
(2)如何运用简单的方法判断粗盐中 是否已除尽?__________。
是否已除尽?__________。
(3)从 溶液到沉淀1的过程中,需蒸发浓缩。在加入固体
溶液到沉淀1的过程中,需蒸发浓缩。在加入固体 之前进行蒸发浓缩优于在加入
之前进行蒸发浓缩优于在加入 之后,原因是___________。
之后,原因是___________。
(4)写出沉淀1受热分解的化学方程式:_________。
(5)为提高 产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
产品的产率,需在滤液中加入氨水,理由是_______;步骤X包括的操作有______。
(6)某同学拟通过实验来测定该纯碱的纯度(假设杂质只含有 ),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的
),他称取w g该样品,将其完全溶解在盛有适量水的烧杯中,然后向烧杯中加入过量的 溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中
溶液,经过滤、洗涤、干燥,称得沉淀的质量为m g,试计算该样品中 的质量分数为____________。(用相关字母表示)
的质量分数为____________。(用相关字母表示)
-
NH4HCO3的分解温度是 35℃。以氯化钾和制取二氧化钛的副产品硫酸亚铁为原料生产铁红颜料和过二硫酸铵等,原料的综合利用率较高。其主要流程如下:
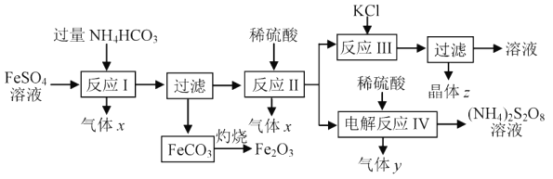
(1)气体x是_________,反应 I 需控制反应温度低于35℃ , 其目的是_______。
(2)反应I的离子方程式为 ___________,FeCO3灼烧的反应方程式为 __________。
(3)各物质的溶解度曲线如图,晶体z是____,简述反应III发生的原因 ________,工业生产上常在反应III的过程中加入一定量的乙醇,其目的是_____________。

(4)反应IV 常用于生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,气体y是__________,阳极发生的电极反应可表示为_______________ 。
-
某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
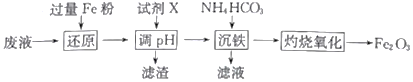
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
| 金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
| 完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
-
某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):

已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
| 金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
| 完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
-
硫酸亚铁是一种重要的化工原料,可以制备多种物质。有关下列制备方法错误的是
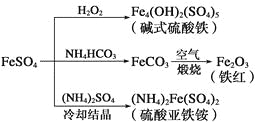
A.制备碱式硫酸铁利用了过氧化氢的氧化性
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质
-
硫酸亚铁是一种重要的化工原料,可以制备多种物质。有关下列制备方法错误的是
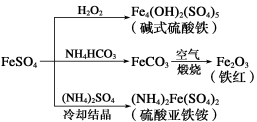
A.制备碱式硫酸铁利用了过氧化氢的氧化性
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质
-
硫酸亚铁是一种重要的化工原料,可以制备多种物质。有关下列制备方法错误的是
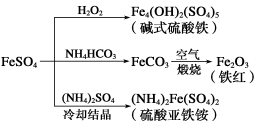
A.制备碱式硫酸铁利用了过氧化氢的氧化性
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.制备(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大这一性质










