-
(15分)X、Y、Z、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次个层电子少数2,W的内层电子已充满,最外层只有一个电子。请回答:
(1)X元素在周期表中的位置是 ;W2+离子的核外电子排布式
(2)Y离子和Z离子比较,半径较大的是 (写离子符号),Z元素和氧元素的简单气态氢化物沸点不同的原因是
(3)Z元素的非金属性比 强,可由一复分解反应推测而得,其反应的化学方程式为
(4)X单质易溶于X与Z形成的三原子化合物中,该化合物分子中的 键与
键与 键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
(5)用H2O2和Z元素最高价氧化物对应水化物的混合溶液可溶解W单质粉末,已知:
①W(s)+2H+(aq)=W2+(aq)+H2(g) ∆H=-64.39KJ/mol
②2H2O2(l)=2H2O(l)+O2(g) ∆H=-196.46KJ/mol
③H2(g)+ O2(g)= H2O(l) ∆H= -285.84 KJ/mol
O2(g)= H2O(l) ∆H= -285.84 KJ/mol
则在Z元素最高价氧化物对应水化物的溶液中,W与H2O2反应生成W2+与H2O的热反应化学方程式为
-
选修X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子的未成对电子数在同周期元素中最多,W形成的单质是空气的主要成分之一, R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为___________;
(2)化合物YX4中Y的杂化方式为__________,ZW3-离子的立体构型是_______。
(3)Y、R的最高价氧化物的沸点较高的是_______(填化学式),原因是____________。
(4)Q元素可形成一种化合物[Q(NH3)4]SO4,该物质中含化学键有________。
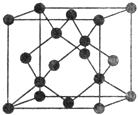
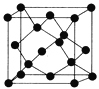
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为________,Y原子的配位数为_______,若晶胞的边长为a nm,晶体的密度为ρg/cm3,则阿伏加德罗常数的数值为____________(用含a和ρ的代数式表示)。
-
A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
元素 相关信息
A A元素原子核外只有三个能级,且每个能级上含有相等的电子数
B 是空气中含量最丰富的元素
C 短周期中,单质C的金属性最强
D 基态原子第三能层上有7种运动状态不同的电子
E 一种核素的质量数为63,中子数为34
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种的分子式为A2H4化合物,该分子中存在σ键与π键数目比为。
(2)H—A、H—B两种共价键中,键能较大的是;H—A、H—D两种共价键中,键的极性较强的是________
(3)E位于周期表中的位置是________ ,单质E与B的最高价氧化物的水化物的稀溶液反应的离子方程式为________。
(4)根据下列能量变化示意图,请写出BO和AO2 反应的热化学方程式________。
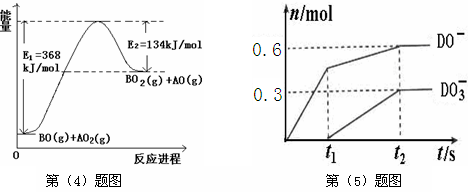
(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为________ 。将一定量的D2 通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如上图所示。请写出t2时刻总反应方程式
-
A,B,C,D,E,F为前四周期中原子序数依次增大的元素,相关的信息如下:
| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | 是空气中含量最丰富的元素 |
| C | 短周期元素中,C的金属性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
| F | 最外层电子数为次外层的3倍 |
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种分子式为A2H4的化合物,该分子中存在σ键和π键数目比为_________,A的杂化类型为_________。
(2)A,B,D,F的氢化物中沸点最高的是_________(写化学式),A,B,F的第一电离能由大到小的顺序是_________。
(3)E位于周期表中的位置是_________,E的基态原子的核外电子排布式为_________。
(4)根据下列能量变化示意图1,请写出BO和AO2反应的热化学方程式_________
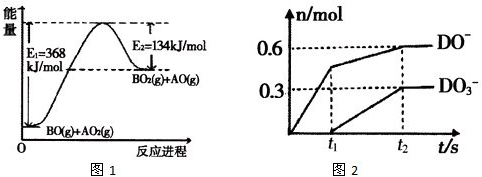
(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为_________,将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示,请写出t2时刻总反应的化学方程式_________。
(6)下图是E和F形成的化合物的晶胞结构示意图,可确定该化合物的化学式为_________,若该晶胞的棱长为apm,则该晶胞的密度为_________g/cm3。

-
(13分)A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C同在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物 |
(1)写出A元素基态原子的价电子排布图________。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:________
(2)常温下,某气态单质甲分子与AB分子核外电子数相等,则一个甲分子中包含________个π键,在A—H、B—H两种共价键中,键的极性较强的是________(用元素符号表示)。D元素原子核内中子数比质子数多1,则D原子可以表示为,其原子核外有________种运动状态不同的电子。
(3)B的氢化物的熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是
________。
(4)通常情况下,A的燃烧热为a kJ ·mol-1,C的燃烧热为b kJ ·mol-1,则C与AO2反应生成A的热化学方程式为________。
-
元素X、Y、Z、W位于元素周期表中前四周期,原子序数依次增大。其相关信息如下:
| 元素 | 相 关 信 息 |
| X | 基态原子核外有三个能级,每个能级的电子数都相等 |
| Y | Y与Z不在同一周期,其原子核外未成对电子数比电子层数多1 |
| Z | 可与W形成两种化合物,且水溶液均呈酸性 |
| W | 是地壳中质量百分含量第二的金属元素 |
请回答:
(1)W的基态原子核外电子排布式是__________。Y单质分子中含________个π键,试比较Y与同周期相邻的两种元素的第一电离能大小关系_____>_____>_____(填元素符号)
(2)X与Z形成的最简单的化合物是一种优良的溶剂,它是由________(填“极性” 、“非极性”) 键构成的________(填“极性”、“非极性”)分子
(3)一定条件下Z与Y可形成YZ3,YZ3与水反应可生成一种弱酸和一种弱碱,试写出该反应的方程式______________________________
(4)X所形成的一种晶体具有高硬度、高熔点特性,属于______(填“分子”、 “原子”或“离子”)晶体,该晶体结构中Z-Z-Z键角为_______。
-
(2015•南昌校级模拟)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为 .
(2)化合物X2W2中W的杂化方式为 ,ZW2﹣离子的立体构型是 .
(3)Y、R的最高价氧化物的沸点较高的是 (填化学式),原因是 .
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为 .
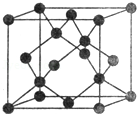
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为 ,Y原子的配位数为 ,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为 (用含a和ρ的代数式表示).
-
选修3——物质结构与性质
已知A、B、C、D、E、F为元素周期表前四周期原子序数依次增大的六种元素。其中A的核外电子总数与其周期数相等,B原子核外有三个能级,每个能级上的电子数相同。D、E为同主族元素,且E的原子序数是D的2倍。F元素在地壳中含量位于金属元素的第二位。回答下列问题:
(1)元素F基态原子价层电子排布式为____________。
(2)B、C、D第一电离能由小到大的顺序为______________。(用元素符号表示)
(3)A与其它元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有 (写出其中两种的化学式)。
(4)BE2分子中,按原子轨道的重叠方式的不同存在的共价键类型有 ;B原子的杂化轨道类型为 ;写出两种与BE2互为等电子体的分子或离子 。
(5)F单质的晶体在不同温度下有两种堆积方式,即面心立方堆积和体心立方堆积,其晶胞的棱边长分别为a cm、b cm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______________,F原子配位数之比为______________。
-
X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
-
E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大。E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态。请回答下列问题:
(1)Y原子基态核外电子排布式为__________;基态Z原子中电子占据的最高能层符号为_________。
(2)F、D、X的电负性由小到大的顺序为__________(用元素符号表示)。
(3)E、F、D、X形成的有机物FX(DE2)2中F的杂化轨道类型为____________,DX3-离子的立体构型是___________。
(4)下列关于F2E2分子和E2X2分子的说法正确的是________。
a.分子中都含σ键和π键 b.F2E2分子的沸点明显低于E2X2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体
(5)将Z单质的粉末加入到DE3的浓溶液中,并通入X2,充分反应后溶液呈深蓝色,该反应的离子方程式为________。
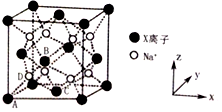
(6)X和Na的一种离子化合物的晶胞结构如图,该离子化合物为_________(填化学式)。Na+的配位数为_________。晶胞有两种基本要素,一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0);B为( ,0,
,0,  ),C为(
),C为( ,
,  ,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg • cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg • cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
键与
键的个数之比是 ;Y元素最高价氧化物对应水化物与小苏打反应的离子方程式为
O2(g)= H2O(l) ∆H= -285.84 KJ/mol






