-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
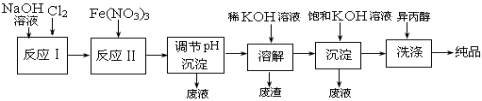
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:

①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应I的化学方程式为________。
③反应II的离子方程式为________。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=________时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠________(填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为________。
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
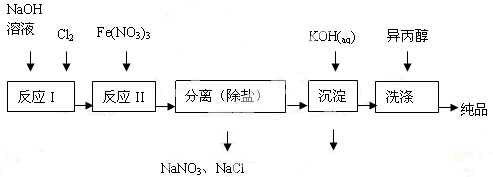
①洗涤粗品时选用异丙醇而不用水的理由是 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定,放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式 。
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应II的离子方程式为________。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为________ 它能净水的原因是________。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整________时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是:________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠________(填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为________。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式:________。
-
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途.干法、湿法制备高铁酸盐的原理如下表所示.
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
 △
△
(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为______.
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:溶解
①反应I的化学方程式为______.
②反应II的离子方程式为______.
③加入饱和KOH溶液的目的是______.
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为______,它能净水的原因是
______.
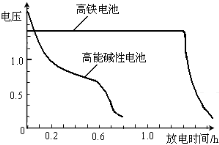
(4)高铁电池是正在研制中的可充电干电池,右图为高铁电池和常用的高能碱性电池的放电曲线,由图可得出高铁电池的优点有:工作电压稳定,______.
-
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
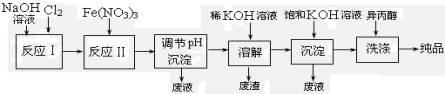

①反应I的离子方程式为 。
②反应II的化学方程式为 。
③加入饱和KOH溶液的目的是 。
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。它能消毒杀菌是因为 ,它能净水的原因是 ____ 。
-
高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾在异丙醇中溶解度非常小。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
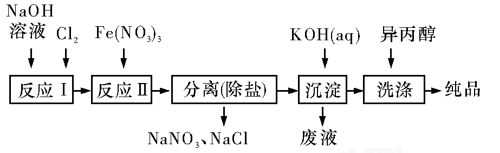
洗涤粗品时选用异丙醇而不用水的理由是:_____________。
反应Ⅱ的离子方程式为__________________________。
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=_____________时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知_____________(填字母)。
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为_____________。
(4)与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为_____________,该电池总反应的离子方程式为_____________。
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
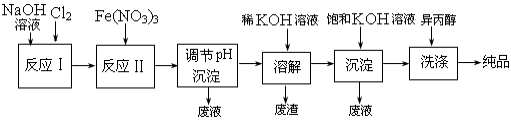
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③进行溶解,沉淀、洗涤这些操作的共同目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为________________。
(3)湿法、干法制备K2FeO4的反应中均利用的是+3价Fe元素的 性质。
(4)高铁电池是正在研制中的可充电干电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。
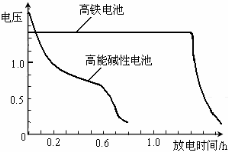
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
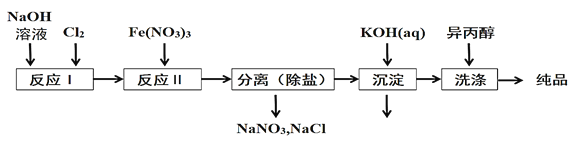
①洗涤粗品时选用异丙醇而不用水的理由是:________。
②反应II的离子方程式为___________。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______它能净水的原因是_______。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____(填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
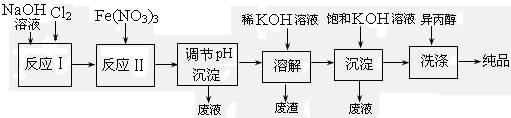
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水
 的原理为________,__________。
的原理为________,__________。
(3)干法制备K2FeO4的反应中,氧化剂与
还原剂的物质的量之比为 。
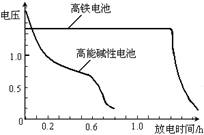
(4)高铁电池是正在研制中的可充电干电池,
右图为该电池和常用的高能碱性电池的
放电曲线,由此可得出的高铁电池的优
点有 、 。
-
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:

①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ;__ __。(用文字表述)
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ; 。
 △
△








 的原理为________,__________。
的原理为________,__________。
