-
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2
 CHCl3+HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃.
CHCl3+HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为 77℃,CHCl3的沸点为 61.2℃.
(1)在密闭容器中,该反应在某催化剂下进行10h,测得如下数据(假设不考虑副反应).
| 实验序号 | 温度℃ | 初始CCl4浓度 | 初始H2浓度 | CCl4的转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为______,在 110℃时平衡常数为______.
②实验1中,CCl4的转化率A______50%(填“大于”、“小于”或“等于”).
③实验2中,10h后达到平衡,H2的平均反应速率为______.在此实验的平 衡体系中,再加入0.5mol CCl4和1.0mol HCl,平衡将向______方向移动.
④实验3中,B的值______(选填序号).
A.等于50% B.大于50% C.小于50% D.从本题资料,无法判断.
-
(10分)为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2 CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
CHCl3+ HCl,此反应伴有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为770C,CHCl3的沸点为61.20C。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)
| 实验序号 | 温度0C | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
(1)1100C时平衡常数:
(2)实验1中,CCl4的转化率A为:________
(3)实验2中,10小时后达到平衡,H2的平均反应速率为:________。在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向________反应方向移动(填“正”、“逆”或“不移动”);
(4)实验3中,B的值________
①等于50% ②大于50% ③小于50% ④无法判断
-
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2  CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。
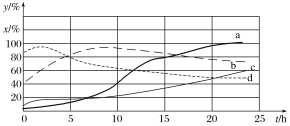
①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L-1时,有利于提高CCl4的平衡转化率和产物中CHCl3的百分含量。
-
绿色化学最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物。以下反应最符合这一要求的是
A.乙烯聚合为聚乙烯 B.光照条件下甲烷与氯气反应制一氯甲烷
C.铜和浓硝酸反应制硝酸铜 D.用铜作催化剂将乙醇氧化为乙醛
-
绿色化学最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物。以下反应最符合这一要求的是
A.铜和浓硝酸反应制硝酸铜
B.用铜作催化剂将乙醇氧化为乙醛
C.乙烯聚合为聚乙烯
D.光照条件下甲烷与氯气反应制一氯甲烷
-
三位科学家保罗克·拉兹等因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如下图所示

下列说法不正确的是
A.氯原子在反应中做催化剂
B.过氧化氯的结构式为:O-Cl-Cl-O
C.臭氧分子最终转变成氧气分子
D.过程②中一氧化氯断键形成过氧化氯
-
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO = 2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的 ______0(填写“>”、“<” 或“=”)。
______0(填写“>”、“<” 或“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)该反应的平衡常数K的表达式为K=_________________________;在该温度下,反应的平衡常数的值为____________
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______
A. 选用更有效的催化剂 B. 升高反应体系的温度
C. 降低反应体系的温度 D. 缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。请在表格中填入剩余的实验条件数据。
| 实验编号 | T/℃ | NO初始浓度 mol·L-1 | CO初始浓度 mol·L-1 | 催化剂的比表面积 m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |
-
[10分]超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H________0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=________。
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在上表空格中填入剩余的实验条件数据。
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |
________
-
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。
2CO2+N2。
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H________0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
-
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO 浓度如下表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K =______。
(2)前2s 内的平均反应速率v(CO2)=________。
(3)在上述条件下反应能够自发进行,则反应的△H___0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是____
A.反应混合物各组分物质的量浓度相等
B. NO 、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗lmolNO的同时,就有lmolCO生成


