-
(12分)稀土元素是周期表中ⅢB族钪、钇和镧系元素之总称,金属活泼性仅次于碱金属和碱土金属元素,它们的性质极为相似,常见化合价为+3价。无论是航天、航空、军事等高科技领域,还是传统工农业,稀土的应用几乎是无所不在。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
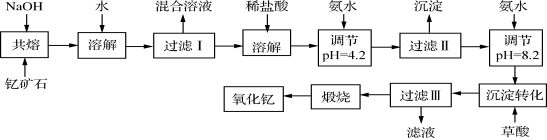
已知:
①有关金属离子形成氢氧化物沉淀时的pH见下表。
| 离子 | 开始沉淀时 的pH | 完全沉淀时 的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
②Be(OH)2+2NaOH  Na2BeO2+2H2O
Na2BeO2+2H2O
请回答下列问题:
(1)过滤Ⅲ所得滤液的溶质主要有______________。
(2)①欲从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用盐酸和________两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(3)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= 。
Fe(OH)3+3H+的平衡常数K= 。
(4)写出煅烧过程的化学方程式 。
-
(11分)Ⅰ.“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中ⅢB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价。钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则最好选用盐酸和________(填字母)
两种试剂,通过必要的操作即可实现。
A.NaOH溶液 B、氨水 C、CO2 D、HNO3
(2)流程图中用氨水调节pH=a时生成沉淀的化学式为________,继续加氨水调至pH=b,此时发生反应的离子方程式为________。
(3)沉淀C为草酸钇,写出草酸钇隔绝空气加热生成Y2O3的化学方程式:________。
Ⅱ镧系元素铈(Ce)是地壳中含量最高的稀土元素,在加热的条件下CeCl3易发生水解。
(4)无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是___
________。
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过反应形成Ce(OH)4沉淀得以分离, 写出反应的离子方程式________。
-
(10分)稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
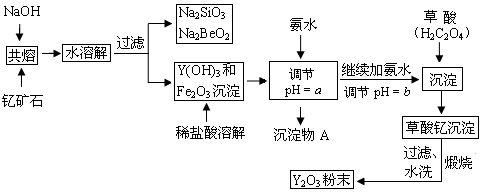
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为▲ 。
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、▲ (填字母)两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:▲ 。
(3)为使Fe3+沉淀完全,须用氨水调节pH = a,则a应控制在▲ 的范围内;检验Fe3+是否沉淀完全的操作方法是▲ 。
-
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
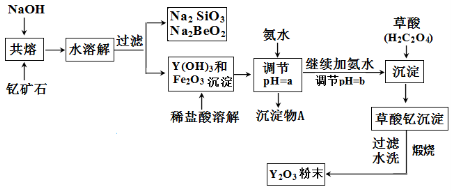
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为 。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸和下列选项中的 试剂(填字母代号),
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
再通过 操作方可实现(填实验操作名称)。
②写出Na2BeO2与足量盐酸发生反应的离子方程式: ;
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在
的范围内;继续加氨水调节pH =b发生反应的离子方程式为 ,溶液中Fe3+完全沉淀的判定标准是 。
-
稀土元素的物理性质和化学性质极为相似,常见化合价为+3价。在合金中加入适量稀土金属,能大大改善合金的性能,所以稀土元素又被称为冶金工业的维生素。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏荇着丰富的含钇矿石(Y2FeBe2Si2O10).,工业上通过如下生产流程可获得氧化钇。
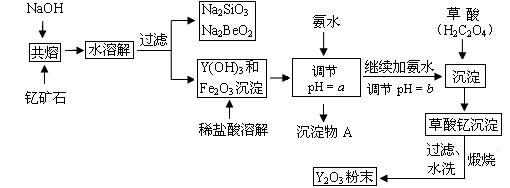
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:

②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)写出钇矿石与氢氧化钠共熔时的化学方程式____________________________。
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸和__________两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式:___________________。
(3)已知10-2.7=2×10-3、10-3.7=2×10-4,则25℃时,反应Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
的平衡常数K=____________。如何检验Fe3+是否沉淀完全____________(回答操作方法,不需设计所用仪器)。
(4)①写出生成草酸钇沉淀的化学方程式_________________________;
②若H2C2O4和湿润的KClO3混合加热到60℃可制得国际公认的高效含氯消毒剂ClO2,写出反应中氧化剂和氧化产物的物质的量之比_________________________。在热水中ClO2会发生反应生成Cl2和HClO2,写出反应的化学方程式____________________。
-
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈
D.四种铈的核素 Ce、
Ce、 Ce、
Ce、 Ce、
Ce、 Ce,它们互称为同素异形体
Ce,它们互称为同素异形体
-
【化学-选修3:物质结构与性质】
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为________________。
(2)AB2分子中,A的杂化类型为________________;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)__________________。
(3)B的氢化物与D的氢化物的沸点较高的是____________(用化学式表示),原因是______________。
(4)AB2形成的晶体的熔点____________(填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是___________________。
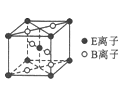
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为____________(用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:_________________________。
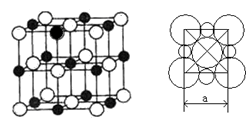
(6)由C、D两元素形成的化合物组成的晶体中,晶体结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为____________g/cm3.(已知阿伏加德罗常数为NA)
-
关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA金属元素是同周期中金属性最强的元素
C.最外层电子数相同原子的元素在周期表中位于同一族,其元素性质一定相似
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
-
下列说法中正确的是( )
A.最外层有2个电子的原子都是金属原子
B.原子最外层电子数相同的元素,其单质的化学性质一定相似
C.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
D.溴元素位于周期表的第7纵行
-
【化学—物质结构与性质】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是________________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中大球代表的离子是_________(填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是_________。
(6)若晶胞的棱长为a cm ,则R2M晶体的密度为=___________g·cm–3。








