-
亚氯酸钠(NaClO2)是重要漂白剂。某小组按如图装置制取无水NaClO2晶体。
已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。
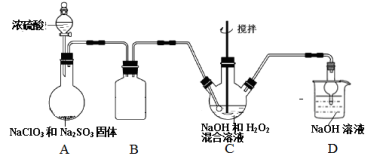
(1)装置A中NaClO3和Na2SO3制备ClO2气体,A中反应的化学方程式为 ;该装置中采用浓硫酸而不用稀硫酸的原因是 。
(2)装置B的作用是 。装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是 、 。
(3)写出装置C中发生的离子方程式 。
(4)从装置C反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;② ;③用 洗涤2~3次;④在 条件下干燥得到成品。
(5)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称m g的样品,加入适量蒸馏水和过量KI晶体,在酸性条件下发生反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100 mL待测溶液.取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的质量分数为 。(用含m、c、V的代数式表示)
-
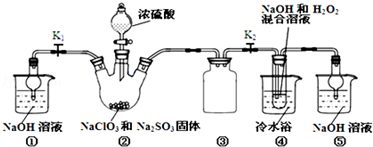
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用如图所示装置制备亚氯酸钠。
完成下列填空:
(1)装置②中产生ClO2的化学方程式为 .装置③的作用是 ;
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤
B.趁热过滤
C.常温洗涤
D.冰水洗涤
E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再 滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是 ;
滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是 ;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 ___________________________。重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL。该样品中NaClO2的质量分数为 。
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。(填化学式)
-
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.

完成下列填空:
(1)装置②中产生ClO2的化学方程式为______.装置③的作用是______.
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②______;③______;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤
D.冰水洗涤 E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是______;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为________________________________.重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL.该样品中NaClO2的质量分数为______.
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > .______(填化学式)
-
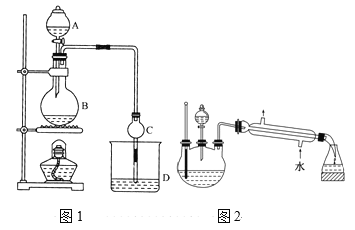
某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH。
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是____;用同位素18O示踪法确定反应产物水分子中氧原子的提供者,若用18O标记乙醇分子中的氧原子,请写出该化学方程式:________。
(2)球形干燥管C的作用是_______。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是_______。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出________;再加入无水硫酸钠除去水,然后进行________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)________。
(6)该实验中用30g乙酸与46g乙醇反应,如果实际得到的乙酸乙酯的质量是26.4g,则该实验中乙酸乙酯的产率是______。(产率指的是某种生成物的实际产量与理论产量的比值。已知乙醇、乙酸、乙酸乙酯的相对分子质量分别为:46、60、88)
-
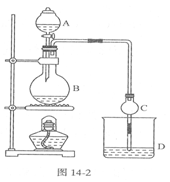
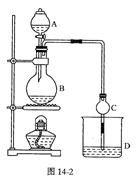
(10分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中 放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素180示踪法确定反应产物水分子
中氧原子的提供者,写出能表示180位置的化学方程式:________
________。
(2)球形干燥管C的作用是________。若反应前向D中加入几滴酚酞,现象:________;反应结束后D中的现象是________ .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
-
(17分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
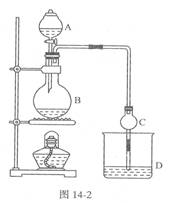
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
第5页
请回答:
(1)浓硫酸的作用是________;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:________。
(2)球形干燥管C的作用是________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);反应结束震荡静止后D中的现象是________ .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”, 来确定副产物中存在乙醚。请你对该同学的观点进行评价:________。
-
(11分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
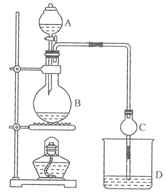
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H ②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:________。
(2)球形干燥管C的作用是________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);反应结束后D中的现象是________ .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________(填物质名称);再加入(此空从下列选项中选择,填编号)________,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
-
(14分)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
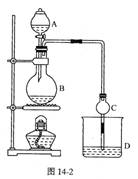
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH ②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:
。
(2)球形干燥管C的作用是________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________;反应结束后D中的现象是________
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
-
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是______;反应化学方程式:______
-
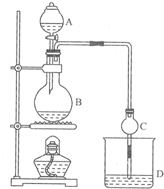
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH ②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:________。
(2)球形干燥管C的作用是________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________;反应结束后D中的现象是________
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰









