-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
CH4
SiH4
NH3
PH3
沸点(K)
101.7
161.2
239.7
185.4
分解温度(K)
873
773
1 073
713.2
分析上表中四种物质的相关数据,请回答:
CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是___________________________________________________________________________。
CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
1.8
2.1
2.5
3.0
0.8
请回答下列有关问题:
估计钙元素的电负性的取值范围:________<X<________。经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中形成的化学键的类型及其理由:__________________________。
高二化学填空题困难题查看答案及解析
-
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为______.
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是______.
(3)已知SnO2是离子晶体,写出其主要物理性质______(写出2条即可).
(4)已知:
分析上表中四种物质的相关数据,请回答:CH4 SiH4 NH3 PH3 沸点(K) 101.7 161.2 239.7 185.4 分解温度(K) 873 773 1073 713.2
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______.
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______.
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时______先液化.高二化学解答题中等难度题查看答案及解析
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________、_________________.
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________该化学键能形成的原因是___________________请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________。
高二化学简答题中等难度题查看答案及解析
-
氮及其化合物在生活、生产和科技等方面有重要应用.请回答下列问题:
(1)氮元素基态原子的价电子排布式为______;
(2)在氮气分子中,氮原子之间存在着______个σ键和______个π键;
(3)氮、氧、氟是同周期相邻的三种元素,比较:
①氮原子的第一电离能______(填“大于”、“小于”或“等于”)氧原子的第一电离能;
②N2分子中氮氮键的键长______(填“大于”、“小于”或“等于”)F2分子中氟氟键的键长;
(4)氮元素的氢化物--NH3是一种易液化的气体,该气体易液化的原因是______;
(5)配合物[Cu(NH3)4]Cl2中含有4个配位键,若用2个N2H4代替其中的2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]Cl2中含有配位键的个数为______.高二化学解答题中等难度题查看答案及解析
-
(9分)氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为________ ________;
(2)在氮气分子中,氮原子之间存放着________个σ键和________个π键;
(3)N2分子中氮氮键的键长________(填“大于”、“小于”或“等于”)
F2分子中氟氟键的键长;
(4)氮元素的氢化物——NH3是一种易液化的气体,该气体易液化的原因
是________ 。
(5)配合物[Cu(NH3)4]C12中含有4个配位键,若用2个N2H4代替其中2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]C12中含有配位键的个数为________。
高二化学填空题简单题查看答案及解析
-
氮及其化合物在生产、生活和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为______________。
(2)在氮分子中,氮原子之间存在着______个σ键和______个π键。
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”、“小于”或“等于”)
①氮原子的第一电离能________氧原子的第一电离能;
②N2分子中氮氮键的键长________白磷(P4)分子中磷磷键的键长;
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是_____________________。
(5)配合物[Cu(NH3)4]Cl2中含有4个配位键,若用2个N2H4代替其中的2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]Cl2中含有配位键的个数为________。
高二化学综合题中等难度题查看答案及解析
-
氮及其化合物在生产、生活和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布图为______________。
(2)在氮分子中,氮原子之间存在着______个σ键和______个π键。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3﹣,请写出两种与N3﹣互为等电子体的分子_______ 、_______。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是_____________________。
(5)NF3、NCl3、NBr3的沸点由高到低的顺序是___________________________。
(6)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体.该反应的化学方程式为_______。
高二化学填空题中等难度题查看答案及解析
-
硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:
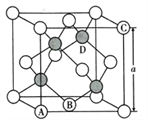
①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________。
②己知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________( 用a、d表示)
高二化学综合题中等难度题查看答案及解析
-
氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1) Li3N晶体中氮以N3-存在,基态N3-的电子排布式为________________。
(2)氮元素可以形成卤化物、氮化物、叠氮化物及配合物等多种化合物。
①NF3、NBr3、NCl3的沸点由高到低的顺序是________,其中NF3中N原子的杂化类型是________,分子的空间构型是________。
②叠氮酸(HN3)是一种弱酸,可电离出N3-,其电离方程式________。另写出两种与N3-互为等电子体的分子________、________。
③氮元素的氢化物—NH3是一种易液化的气体,其易液化的原因是________;
(3)配合物[Cu(NH3)4]Cl2中Cu2+的配位数是________。
(4) (CH3)3NH+和AlCl4—可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作________(填代号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
高二化学填空题中等难度题查看答案及解析
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
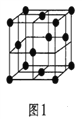
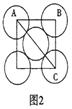
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
高二化学填空题中等难度题查看答案及解析