-
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为______.
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是______.
(3)已知SnO2是离子晶体,写出其主要物理性质______(写出2条即可).
(4)已知:
分析上表中四种物质的相关数据,请回答:CH4 SiH4 NH3 PH3 沸点(K) 101.7 161.2 239.7 185.4 分解温度(K) 873 773 1073 713.2
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______.
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______.
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时______先液化.高二化学解答题中等难度题查看答案及解析
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________、_________________.
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________该化学键能形成的原因是___________________请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________。
高二化学简答题中等难度题查看答案及解析
-
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥生产等方面有重要应用。请回答下列问题:
(1)砷原子的核外电子排布式为_____________________________________。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为________,该化学键能够形成的原因是______________________________________________________。
(3)NH4+中氮原子的杂化类型为________,NH4+的空间构型为________。
(4)已知:
CH4
SiH4
NH3
PH3
沸点(K)
101.7
161.2
239.7
185.4
分解温度(K)
873
773
1 073
713.2
分析上表中四种物质的相关数据,请回答:
CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是___________________________________________________________________________。
CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是_________________________________________________________________________。
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时________先液化。
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
元素
Na
Mg
Al
Si
P
S
Cl
K
电负性
0.9
1.2
1.5
1.8
2.1
2.5
3.0
0.8
请回答下列有关问题:
估计钙元素的电负性的取值范围:________<X<________。经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlCl3中形成的化学键的类型及其理由:__________________________。
高二化学填空题困难题查看答案及解析
-
钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)在元素周期表中,锆元素与钛元素同族,则锆元素位于__区。
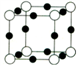
(2)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形成存在的钛酰阳离子,其结构如图所示,若阳离子所带电荷为+n,则该离子中钛原子数为__。
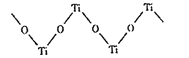
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与__个N原子相连,与同一个N原子相连的Al原子构成的立体构型为___,氮化铝晶体属于___晶体。
(4)Ti3+可形成配位数为6的两种配合物晶体(一种是紫色,一种是绿色),组成皆为TiCl3•6H2O。向含有0.01mol绿色配合物晶体的水溶液中加入过量硝酸银溶液,产生0.02molAgCl沉淀,则绿色配合物晶体的化学式为__。
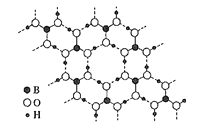
(5)硼与铝同族,硼酸晶体是片层结构,其中一层的结构如图所示,层内的分子以氢键相连。含1mol硼酸的晶体中有__mol氢键。图中所示最外层已达8原子结构的原子是__(填元素符号),H3BO3晶体中B原子个数与极性键个数比为__。
高二化学填空题中等难度题查看答案及解析
-
碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_____个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________________________________。
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______,微粒之间存在的作用力是_______。
(6)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为________,该晶体中微粒间的作用力是____________。
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为____________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(8) CaC2中C22−与O22+互为等电子体,O22+的电子式可表示为________。
高二化学综合题中等难度题查看答案及解析
-
碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。
(1)锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是______,该能级的电子云轮廓图为________。Ge的晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于_______晶体。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为_______,(CH3)3C+中碳骨架的几何构型为________。
(3)治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_______。
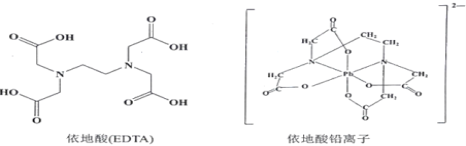
A.形成依地酸铅离子所需n(Pb2+)∶n(EDTA)=1∶4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(4)下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:
碳酸盐
MgCO3
CaCO3
SrCO3
BaCO3
热分解温度/℃
402
900
1172
1360
阳离子半径/pm
66
99
112
135
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:__________。
(5)有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
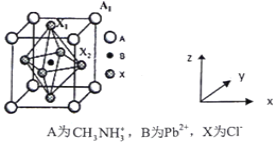
①若该晶胞的边长为anm,则Cl-间的最短距离是________。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于____位置。
高二化学综合题中等难度题查看答案及解析
-
ⅣA族元素及其化合物在材料等方面有重要用途
回答下列问题:
(1)碳的一种单质的结构如图
所示
碳原子的杂化轨道类型为______.
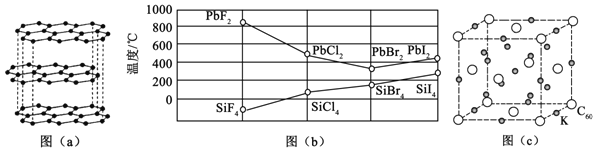
(2)
分子的立体构型为______,属于______分子
填“极性”或“非极性”
.
(3)四卤化硅
的沸点和二卤化铅
的熔点如图
所示.
的沸点依F、Cl、Br、I次序升高的原因是______.
结合
的沸点和
的熔点的变化规律,可推断:依F、Cl、Br、I次序,
中的化学键的离子性______填“增强”“不变”或“减弱”
.
(4)碳的另一种单质
可以与钾形成低温超导化合物,晶体结构如图
所示
位于立方体的棱上和立方体的内部,此化合物的化学式为______,其晶胞参数为
,晶体密度为______
(列计算式).
高二化学综合题困难题查看答案及解析
-
前四周期的元素及其化合物在生产、生活、化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式_________________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_______。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_______________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
(4)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 ______ (填元素符号)
元素
氟
氯
溴
碘
第一电离能(kJ/mol)
1681
1251
1140
1008
②根据价层电子对互斥理论,预测ClO4-的空间构型为_______形,C1O2- 中Cl原子的杂化方式为_________。
③元素C、O、F、H的电负性由大到小的顺序为______________________。
高二化学综合题中等难度题查看答案及解析
-
硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入 [Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀, Cu+基态核外电子排布式为 ______ .
②CaC2中
与
互为等电子体. 1mol
中含有的π键数目为 ______ .
③乙炔与氢氰酸反应可得丙烯睛(CH2=CHC=N),丙烯腈分子中碳原子轨道杂化类
型是 ______ ,构成丙烯腈元素中第一电离能最大的是 ______.
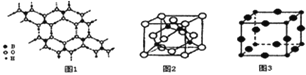
(2)硼酸 (H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1),则1mol H3BO3的晶体中有 ______ mol氢键.硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示
黑点代表铜原子,空心圆代表M原子
.
该晶体化学式为 ______ .
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______
填“离子”、“共价”
化合物.
(4)Cu3N的晶胞结构如右上图3, N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______ g·cm-3。(阿伏加德罗常数用
表示)
高二化学综合题中等难度题查看答案及解析
-
甘油是一种在医药、化妆品等方面应用广泛的保湿、保润剂,也是一种重要的工业原料,可用于合成环氧树脂、油脂、硝化甘油(三硝酸甘泊酯)等。由烷烃A合成甘油及其衍生物的一种路线如下图所示,请回答下列问题。
己如:①烷烃A的相对分子质量为44;B的核磁共振氢谱有两个峰。
②

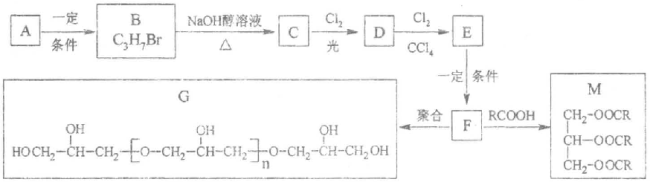
(1)A 的分子式(或化学式)为__________,F的官能团是____________。
(2)B→C的反应类型属于___________反应;F→G的反应类型属于_______(填“加聚”或“缩聚”)反应。
(3)B 的同分异构体的结构简式为_________,C与Cl2反应除生成D 外,另一无机产物为_______(写化学)。
(4)由D→E的化学方程式为:__________________。
(5)硝化甘油既是一种炸药,也是一种心绞痛急救药,它可由F 与硝酸制得。硝化甘油的结构简式为____________。
(6)1 mol M与足量的NaOH 洛液完全反应,至少消耗NaOH_______mol。
高二化学推断题极难题查看答案及解析