-
100℃时,在1L恒温恒容的密闭容器中,通入0.1 mol N2O4,发生反应:N2O4(g)  2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
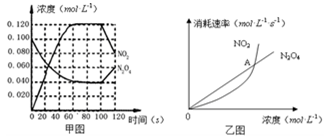
(1)在0~60s内,以N2O4表示的平均反应速率为 ________ mol·L-1·s-1 。
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数K1=________ =0.36mol.L-1.S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2 ,则k1________k2 (填“>”、“<”或“=”)。(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是________。
A.降低温度 B.通入氦气使其压强增大 C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中, 交点A表示该反应的所处的状态为________。
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(5)已知N2(g)+2O2(g)=2NO2(g) △H= +67.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534.7 kJ·mol-1
N2O4(g)  2NO2(g) △H= +57.0 kJ·mol-1
2NO2(g) △H= +57.0 kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=________kJ·mol-1
-
(创新预测题)(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
| t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l) H4SiO4(aq) ΔH
H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。
-
(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
| t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
请回答下列问题:
①表中a=________,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为________________________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:____________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是_______________________________。
-
100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g)  N2O4(g) ΔH<0,下列说法正确的是( )
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
-
100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g)  N2O4(g) ΔH<0,下列说法正确的是( )
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
-
100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g)  N2O4(g) ΔH<0,下列说法正确的是( )
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
-
已知:N2O4(g) 2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol/L | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A. 升高温度会使混合气体的颜色变浅
B. 反应达平衡时,吸收的热量为0.30Q kJ
C. 20~40s内,v(N2O4)=0.004mol/(L·s)
D. 100s时再充入0.40mo1N2O4,达到新平衡时N2O4的转化率增大
-
在100℃时,将0.40 mol NO2气体充入2 L的密闭容器中,发生如下反应:2NO2(g)  N2O4(g) ∆H < 0。监测反应获得如下数据:
N2O4(g) ∆H < 0。监测反应获得如下数据:
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s内,v(NO2) = 0.005 mol·L-1.s-1
B.59 s时,c(NO2)一定大于0.12 mol·L-1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K > 25/9
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4) < 0.08 mol
-
(12分)已知:N2O4(g) 2NO2(g) ΔH=+52.70 kJ·mol—1。
2NO2(g) ΔH=+52.70 kJ·mol—1。
(1)在恒温、恒容的密闭容器中进行上述反应时,下列描述中能说明该反应已达平衡的是。
a.v(N2O4)正=2 v(NO2)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(2)t℃恒温下,在固定容积为2L的密闭容器中充入0.054 mol N2O4,半分钟后达到平衡,测得容器中含n(NO2)=0.06 mol,则v(NO2) =,t℃时反应N2O4(g) 2NO2(g)的平衡常数K=。若向容器内继续通入少量N2O4,则平衡移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后NO2的体积分数原平衡时NO2的体积分数(填“大于”、“小于”或“等于”)。
2NO2(g)的平衡常数K=。若向容器内继续通入少量N2O4,则平衡移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后NO2的体积分数原平衡时NO2的体积分数(填“大于”、“小于”或“等于”)。
(3)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是。
N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是。
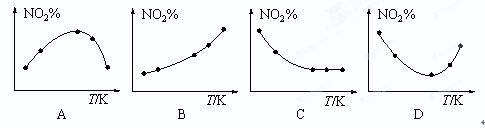
-
无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2之间存在反应:N2O4(g) 2NO2 (g) ΔH=+57.2 kJ/mol。
2NO2 (g) ΔH=+57.2 kJ/mol。
(1)将一定量N2O4加入到恒温恒容的密闭容器中。
①能说明该反应达到平衡状态的是____
a.v正(N2O4)=2v逆(NO2)
b.容器中气体的温度不变
c.容器中气体平均相对分子质量不变
d.混合气体密度不变
②达到平衡状态后,保持体积不变升高温度,再次到达平衡状态时混合气体颜色_______(填“变深”、“变浅”或“不变”), 判断理由___________。
(2)将一定量N2O4加入到恒温恒压的密闭容器中(温度298K、压强100kPa)。该反应中,正反应速率v正=k正×p(N2O4),逆反应速率v逆=k逆×p2(NO2),其中k正、k逆为速率常数,p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=_____(以k正、k逆表示)。若该条件下k正=4.4×104s-1,当N2O4分解10%时,v正=____kPa·s-1
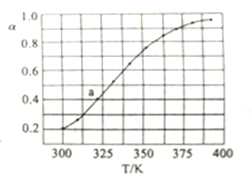
(3)将一定量N2O4加入到恒容密闭容器中。测得不同温度下,N2O4的平衡转化率a如图所示。已知N2O4的起始压强p0为210kPa,计算图中a点对应温度下反应的压强平衡常数Kp=______。
2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,

2NO2(g) △H= +57.0 kJ·mol-1

