-
天然气部分氧化制取的化工原料气中,常含有氧硫化碳(COS,结构类似于CO2),目前氧硫化碳脱除可采用氢解和水解两种方法,其反应原理如下:
氢解:COS(g)+H2(g) H2S(g)+CO(g)
H2S(g)+CO(g)
水解:COS(g)+H2O(g) H2S(g)+CO2(g)
H2S(g)+CO2(g)
(1)氧硫化碳的电子式为________________________________。
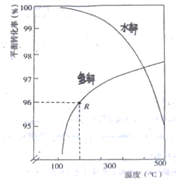
(2)如下图是氧硫化碳水解和氢解平衡转化率随温度变化曲线。
①观察图像,水解与氢解相比优势为_________________________________。
②水解的△H___0(填“大于"或“小于”)
③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点所示体系的能量变化为______kJ(只列式,不必计算)。
(3)氢解和水解产生的H2S必须进行回收处理,酸性、可溶性铁盐氧化H2S制取硫磺工艺备受重视。
①写出酸性条件下用氢氧化铁溶液吸收H2S制取硫磺的离子方程式___________________________。
②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,写出电解时总反应的离子方程式:__________。
③常温下,在c(H+)=0.30mo/L的酸性溶液中通入H2S至饱和,测得硫化氢的平衡浓度为0.10mol/L,计算此时溶液中c(S2-)=_______[忽略H2S电离生成的H+,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15,结果保留两位有效数字。]
-
天然气部分氧化制取的化工原料气中,常含有氧硫化碳(COS,结构类似于CO2),目前氧硫化碳脱除可采用氢解和水解两种方法,其反应原理如下:
氢解:COS(g)+H2(g) H2S(g)+CO(g)
H2S(g)+CO(g)
水解:COS(g)+H2O(g) H2S(g)+CO2(g)
H2S(g)+CO2(g)
(1)氧硫化碳的电子式为________________________________。
(2)如下图是氧硫化碳水解和氢解平衡转化率随温度变化曲线。
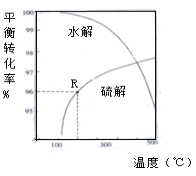
①观察图像,水解与氢解相比优势为_________________________________。
②水解的△H=___0(填“大于"或“小于”)
③已知:1molCOS(g)完全氢解能量变化为6.99kJ,若初始COS的物质的量为nmol,从反应开始到R点所示体系的能量变化为______kJ(只列式,不必计算)。
(3)氢解和水解产生的H2S必须进行回收处理,酸性、可溶性铁盐氧化H2S制取硫磺工艺备受重视。
①写出酸性条件下用氯氧化铁溶液吸收H2S制取硫磺的离子方程式___________________________。
②吸收H2S后的酸性废液中的Fe2+,可通过电解法使Fe3+再生,写出电解时总反应的离子方程式:__________。
③常温下,在c(H+)=0.30mo/L的酸性溶液中通入H2S至饱和,测得硫化氢的平衡浓度为0.10mol/L,计算此时溶液中c(S2-)=_______[忽略H2S电离生成的H+,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-15,结果保留两位有效数字。]
-
人们在研究金星大气成分时发现金星大气中有一种称为硫化羰(COS)的分子,其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列有关COS的推测不正确的是( )
A.COS分子是含有极性键的极性分子
B.COS的电子式为:
C.COS的分子中所有原子满足8电子稳定结构
D.硫化羰分子中三个原子处于同一直线上
-
羰基硫(COS)广泛存在于煤、石油和天然气为原料的化工生产中,不经处理直接排放会引起大气污染,石油化工中产生的羰基硫可通过以下方法脱除。
Ⅰ.干法脱除:在催化剂存在下,COS和H2可发生两个平行反应:
i. COS(g)+H2(g) H2S(g)+CO(g)△H1=-17kJ/mol
H2S(g)+CO(g)△H1=-17kJ/mol
ii. COS(g)+4H2(g) H2S(g)+CH4(g)+H2O(g) △H2
H2S(g)+CH4(g)+H2O(g) △H2
(1)已知:CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
(2)T1℃时,向10L恒容密闭容器中充人1molCOS和4molH2,发生反应i和ii。5min时达到平衡,测得体系压强减少了20%,CO的体积分数为10%且其平衡分压为P1。
①0-5min内,v(COS)=______________。
②反应i的平衡常数K=______________。
③若在起始温度为T1℃的绝热容器中重复上述实验,H2的平衡分压P2______________P1(填“>”“=”或“<”),理由为______________。
Ⅱ.湿法脱除:原理为COS+4OH-=S2-+CO32-+2H2O。温度为293K时,将COS以固定流速匀速通入一定浓度的NaOH溶液中,测得体系内c(S2-)随时间(t)的变化如图所示:
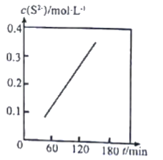
(3)由图可知,增大NaOH溶液的初始浓度,COS的吸收速率______________(填“增大”“减小”或“不变”),判断依据为______________。
(4)在上述反应体系中同时加入少量溴水,也能吸收COS并得到澄清溶液,发生反应的化学方程式为______________。
-
硫化碳又称氧硫化碳(化学式为COS),是农药、医药和其它有机合成的重要原料。COS的合成方法之一是在无溶剂的条件下用CO与硫蒸气反应制得,该法流程简单、收效高,但含有CO2、SO2等杂质。
(1)COS的电子式为_________。
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g) C2H5OH+3H2O(g) △H=-173.6 kJ/mol
C2H5OH+3H2O(g) △H=-173.6 kJ/mol
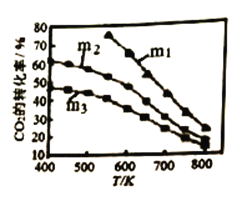
下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m= ,为起始时的投料比,则 m1、m2、m3从大到小的顺序为_______,理由是____________。
,为起始时的投料比,则 m1、m2、m3从大到小的顺序为_______,理由是____________。
(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS 水解的化学方程式为_________________。
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83 kJ热量。该脱硫反应的热化学方程式为_________________。
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为___________,该反应的阳极材料是______。
④常温下,HCl和CuCl2的混合溶液中,c(H+) =0.30mol/L,c(Cu2+) =0.10mol/L,往该溶液中通入H2S 至饱和(H2S的近似浓度为0.10mol/L),_____(填“能”或“不能”)出现沉淀,用必要的计算过程和文字说明理由。
(已知Ka1(H2S)= 1.3×10-7,Ka2(H2S)= 7.0×10-5,Ksp(CuS) = 1.4×10-36)
-
Ⅰ.羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染,研究其脱除方式意义重大。回答下列问题:
(1)COS 的分子结构与 CO2 相似,COS 的电子式为_____。
(2)已知:① CO(g)+H2O(g)  H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1
H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1
② COS(g)+H2O(g)  H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1
则氢气脱除 COS 生成 CO 和 H2S 的热化学方程式为________________________________。
II. 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H 等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) = Si(s) + 4HCl(g) △H = + 236 kJ/mol
| 键能 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| (kJ·mol-1) | 460 | 360 | 436 | 431 | x | 347 |
表中 x=_____。
Ⅲ. “绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3 = 7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图:

负极反应式为____________, 标准状况下有 4.48 L NO2 被处理时,转移电子的物质的量为_______mol。
-
为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛。该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2。之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用。某研究小组用500 mL 1 mol/L K2CO3溶液吸收5.6 L 的CO2(标准状况)形成富液(忽略溶液体积变化)。
(1)碳酸钾溶液吸收CO2,发生反应的离子方程式是 。
(2)该富液中的溶质是__________(填化学式)。
(3)该富液中,下列说法正确的是________。
a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b.c(CO32-) + c(HCO3-) + c(H2CO3)=2mol/L
c.c(K+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
(4)高温加热该富液,得到K2CO3溶液。发生反应的化学方程式是______________。
(5)电解法也可以使K2CO3溶液再生。其原理如下图所示,富液应进入 (填“阴极”或“阳极”)室。结合方程式简述再生K2CO3的原理是 。
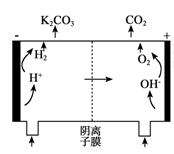
-
为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛。该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2。之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用。某研究小组用500 mL 1 mol/L K2CO3溶液吸收5.6 L 的CO2(标准状况)形成富液(忽略溶液体积变化)。
(1)碳酸钾溶液吸收CO2,发生反应的离子方程式是 。
(2)该富液中的溶质是__________(填化学式)。
(3)该富液中,下列说法正确的是________。
a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b. c(CO32-) + c(HCO3-) + c(H2CO3)=2 mol/L
c.c(K+) > c(HCO3-) > c(CO32-) > c(OH-) > c(H+)
(4)高温加热该富液,得到K2CO3溶液。发生反应的化学方程式是_________________。
(5)电解法也可以使K2CO3溶液再生。其原理如下图所示,富液应进入 (填“阴极”或“阳极”)室。结合方程式简述再生K2CO3的原理是 。
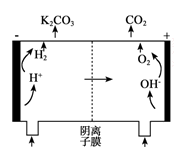
-
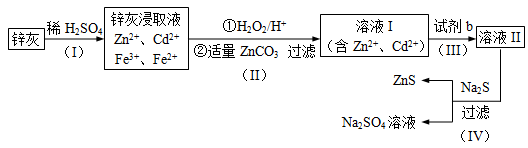
【化学——选修2化学与技术】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。
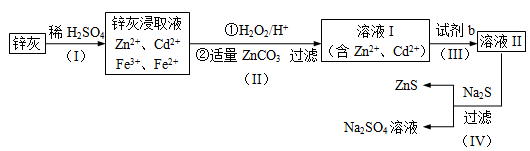
(1)为提高锌灰的浸取率,可采用的方法是 (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是 (写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是 ,
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为_______________________________;
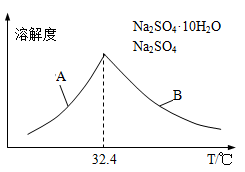
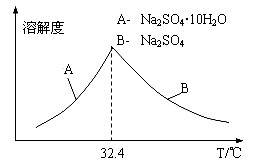
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是 。
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。
-
硫化锌 (ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。
(1)为提高锌灰的浸取率,可采用的方法是 (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是 (写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是 ;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为________;
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是 。
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。
H2S(g)+CO(g)
H2S(g)+CO2(g)










