-
已知:2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ/mol;Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系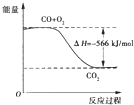
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
-
已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为 283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
-
已知:2CO(g)+O2(g) 2CO2(g) ΔH=−566 kJ·mol−1;
2CO2(g) ΔH=−566 kJ·mol−1;
Na2O2(s)+CO2(g) Na2CO3(s)+
Na2CO3(s)+ O2(g) ΔH=−226 kJ·mol−1
O2(g) ΔH=−226 kJ·mol−1
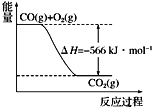
根据以上热化学方程式和图像判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>−452 kJ·mol−1
C. 上图可表示由1 mol CO生成CO2的反应过程和能量关系
D. 根据以上热化学方程式无法求算Na2O2(s)+CO(g)===Na2CO3(s)的反应热
-
已知:2CO(g)+O2(g) 2CO2(g) ΔH=−566 kJ·mol−1;
2CO2(g) ΔH=−566 kJ·mol−1;
Na2O2(s)+CO2(g) Na2CO3(s)+
Na2CO3(s)+ O2(g) ΔH=−226 kJ·mol−1
O2(g) ΔH=−226 kJ·mol−1
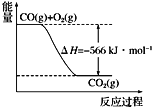
根据以上热化学方程式和图像判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>−452 kJ·mol−1
C.上图可表示由1 mol CO生成CO2的反应过程和能量关系
D.根据以上热化学方程式无法求算Na2O2(s)+CO(g)===Na2CO3(s)的反应热
-
已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;②Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为 283 kJ
B. 反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C. 反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
-
已知:Na2O2(s)+CO2(g) Na2CO3(s) +
Na2CO3(s) + ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
2CO(g)+O2(g) 2CO2(g) ΔH=-566 kJ/mol
2CO2(g) ΔH=-566 kJ/mol

 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
B.2Na2O2(s)+2CO2(g) =2Na2CO3(s)+O2(g) ΔH=+452 kJ/mol
C.右图可表示由CO生成CO2的反应过程和能量关系
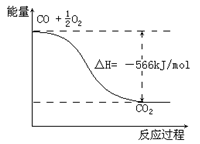
D.CO(g)与Na2O2(s)反应生成1molNa2CO3(s)时放出509kJ的热量
-
已知:① C(s) + O2(g) == CO2(g); △H = -393.5 kJ•mol-1
② 2CO(g) + O2(g) == 2CO2(g); △H = -566 kJ•mol-1
③ TiO2(s) + 2Cl2(g) == TiCl4(s) + O2(g); △H = +141 kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)== TiCl4(s) + 2CO(g) 的△H = _______________。
-
(1)已知:① C(s) + O2(g)=CO2(g) H=-393.5 kJ•mol-1
②2CO(g) + O2(g)=2CO2(g) H=-566 kJ•mol-1
③TiO2(s) + 2Cl2(g)=TiCl4(s) + O2(g) H=+141 kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)=TiCl4(s) + 2CO(g)的H=_________________。
(2)氯化银在水中存在沉淀溶解平衡AgCl(s) Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 mol•L-1氯化铝溶液中,银离子浓度最大可达到_____________mol•L-1。
Ag+(aq) + Cl-(aq)。25℃时,氯化银的Ksp=1.8×10-10,现将足量的氯化银加入到0.1 mol•L-1氯化铝溶液中,银离子浓度最大可达到_____________mol•L-1。
(3)20 ℃时,0.1 mol•L-1 NH4Al(SO4)2溶液的pH=3,则:2c(SO42-)-c(NH4+)-3c(Al3+)≈______________mol•L-1(填数值)。
-
已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH=________。
-
已知下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ•mol-1
通过计算(要有计算过程),写出1mol C与液态H2O反应生成CO和H2的热化学方程式______.
O2(g) ΔH=-226 kJ/mol



