-
(本题15分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
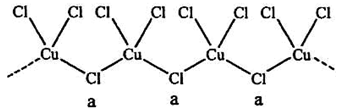
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为__________。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为___________;
(4)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因_________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(7)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu===2Fe2++Cu2+,请写出其第l步反应的离子方程式__________________________________。
-
[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是________,铜的基态原子核外电子排布式为__________,元素铁与铜的第二电离能分别为:ICu="1958" kJ·mol-1、IFe="1561" kJ·mol-1,ICu比IFe大得多的原因是_______。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
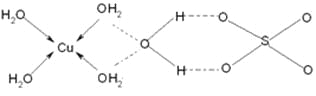
图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
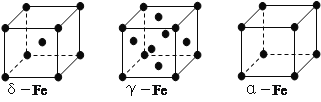
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为___________。
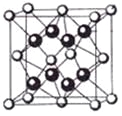
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为______________。
-
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
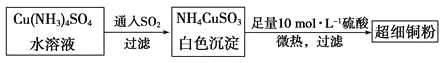
①Cu2+的价电子排布图________________; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②SO42-的空间构型为_____________,SO32-离子中心原子的杂化方式为__________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:___________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是________
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_____________________.
-
铜(Cu)是一种重要的常见金属,现代电子器件的电路离不开它,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:
(1) 向CuSO4溶液里逐滴加入氨水,首先生成蓝色难溶物,然后得到深蓝色溶液。由蓝色难溶物得到深蓝色溶液的离子方程式为__________________ ;写出该深蓝色离子能反映出特殊共价键的结构简式________________;
(2) 元素金(Au)处于周期表中的第六周期,与Cu同族。一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶角位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________________________;
(3) 上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的最简化学式应为________。
-
(16分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________。
(2)SO42ˉ的立体构型是________,其中S原子的杂化轨道类型是________。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为________。一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________,该晶体中,原子之间的作用力是________。
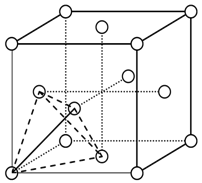
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如下图),该晶体储氢后的化学式应为________;假设在另一条件下,氢原子可进入到由Cu原子与Au原子构成的八面体空隙中心,该晶体储氢后的化学式为________。(提示:查找四面体、八面体时,需假设Cu原子与Au原子等同;每个四面体、八面体内只填充一个氢原子)
-
(10分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
-
(13分)铜(Cu)是重要金属,铜的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)向CuSO4浓溶液中滴入浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液。再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4•H2O晶体。
①沉淀溶解的离子方程式为_______________________________________________。
②乙醇的作用是_________________________________________________________。
③[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的立体构型为____________________,其中N原子的杂化轨道类型是________。
(2)金(Au)与铜为同族元素,铜与金可形成具有储氢功能的合金。
①合金中,原子间的作用力是_______________。已知Au为第六周期元素,则基态Au原子的价电子排布式为________,Au的原子序数为________。
②该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心、Au原子位于顶点,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,则该晶体储氢后的化学式为_______________。
-
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________________________________________________________________________。
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是________________________________________________________________________。
(3)SO 中S以sp3杂化,SO
中S以sp3杂化,SO 的立体构型是________。
的立体构型是________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,金原子最外层电子排布式为____________。一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为________;该晶体中,原子之间的作用力是________________________________________________________________________。
(5)CuSO4晶体的构成微粒是________和________,微粒间的作用力是________,该晶体属于________晶体。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为________。
-
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
-
铜(Cu)是重要金属,铜的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)向CuSO4浓溶液中滴入浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液。再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4•H2O晶体。
①沉淀溶解的离子方程式为_______________________________________________。
②[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的立体构型为_________________(用文字表述),其中N原子的杂化轨道类型是________。
(2)金(Au)与铜为同族元素,铜与金可形成具有储氢功能的合金。
①合金中,原子间的作用力是_______________。已知Au为第六周期元素,则基态Au原子的价电子排布式为________。
②该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心、Au原子位于顶点,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,则该晶体储氢后的化学式为_______________。





