-
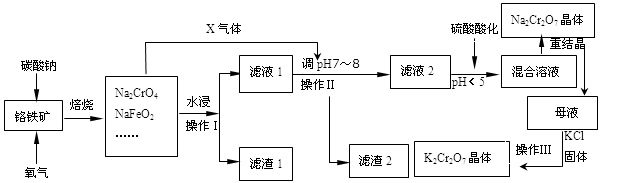
重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示FeO·Cr2O3,还含有 SiO2、 Al2O3 等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:
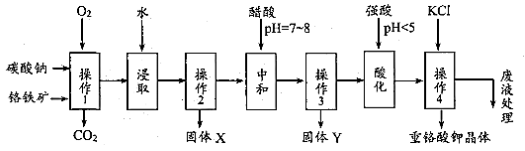
请回答下列问题:
操作1中发生的反应有:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
Na2CO3+Al2O3 2NaAlO2+CO2↑;Na2CO3+SiO2
2NaAlO2+CO2↑;Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
该步骤在常温下的反应速度较慢,为使反应速率增大,可采取的两条措施是____________。
(2)固体Y 中主要含有______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化,请写出离子反应方程式______________________。
(4)操作 4 中的化学反应在溶液中能发生的可能理由是_________________________;获得 K2Cr2O7 晶体的操作依次是:加入KCl 固体,在水浴上加热浓缩至______________,冷却结晶,抽滤,洗涤,干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:称取重铬酸钾试样 1.470g,用100mL 容量瓶配制成溶液。移取25.00mL 溶液于碘量瓶中,加入适里稀硫酸和足量碘化钾(铬的还原产物为 Cr3+),放于暗处 5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L 标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-;则所测产品中重铬酸钾的纯度为_____________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是_________.
A.粗产品若要进一步提纯,可以采用重结晶的方法
B. 配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
-
(1)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图。根据题意回答问题:

已知:①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
(2)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。酸化步骤用醋酸调节溶液pH<5,其目的是________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、_______、过滤、_______、干燥。
-
Ⅰ.某化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3 ,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7 ·2H2O),其主要工艺流程如下图:
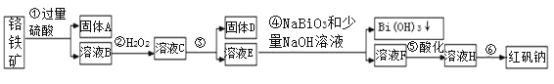
查阅资料得知:
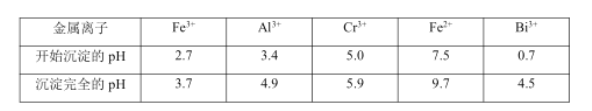
i.常温下,NaBiO3 不溶于水,有强氧化性,在碱性条件下,能将 Cr 3+ 转化为CrO42- 。
ii.
回答下列问题:
(1)步骤③加的试剂为氢氧化钠溶液,此时溶液 pH 要调到5的目的是_________ 。
(2)写出④反应的离子反应方程式:________________
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是____________ (填操作名称)。
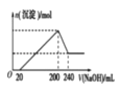
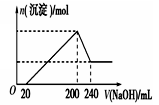
(4)取一定质量的固体 D 溶解于 200mL 的硫酸中,向所得溶液中加入5mol/L 的NaOH 溶液,生成沉淀的物质的量n与加入NaOH 溶液的体积V 关系如图所示,则硫酸的浓度为_______ ,固体 D 中含铁化合物的物质的量为__________ 。
Ⅱ.经检测该化工厂的工业废水中含 5.00×10 -3 mol·L -1 的 Cr2O72- ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4 (Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
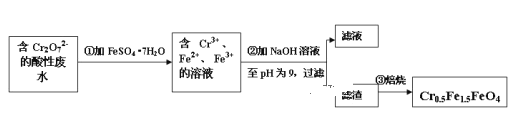
(1)第①步反应的离子方程式_______________ 。
(2)欲使 1L 该废水中的 Cr2O72- 完全转化为 Cr 0.5 Fe 1.5 FeO4 。理论上需要加FeSO4 ·7H2O 的质量为 ________g (已知 FeSO 4 ·7H2O 的摩尔质量为 278g/mol)。
-
(14分)以铬铁矿(主要成分为FeO和Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(红矾钠的主要成分为重铬酸钠:Na2Cr2O7·2H2O),其主要工艺流程如下:
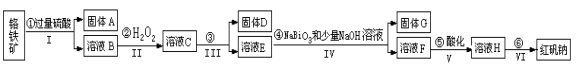
查阅资料得知:
i. 常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ii.
| 物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是 。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和__________(填仪器名称)。
(3)写出④反应的离子反应方程式 。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式 。
(5)将溶液H经过下列操作,蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200mL的硫酸中,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V关系如图所示,则硫酸的浓度为 ,固体D中含Fe化合物的物质的量为 。
-
重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分Fe(CrO2)2(或写成FeO·Cr2O3),还含有Al2O3、Fe2O3、SiO2等杂质]制备,同时还可回收Cr。其主要工业流程如图所示:
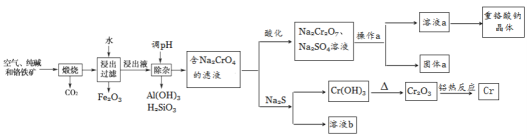
已知部分物质的溶解度曲线如图1所示。
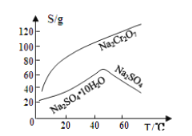
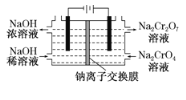
图1 图2
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为______________________________。
(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有_________(填化学式)。
(3)调节溶液的pH所选的试剂为__________________(填名称)。
(4)操作a的实验步骤为 _________________________。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,写出生成Cr(OH)3的离子方程式__________________________________。
(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。
①写出电极b的电极反应方程式:___________________________________。
②测定阳极液中Na元素和Cr元素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为____________。
(7)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________mol·L-1 ,废水处理后方能达到国家排放标准。
-
(14)铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
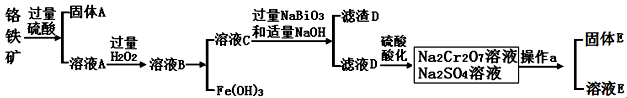
查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
②常温下,Ksp[Cr(OH)3]=6.3×10-31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝 热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,不选用盐酸的原因是 。
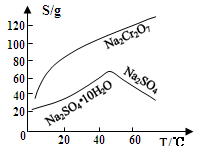
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全 ;
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
-
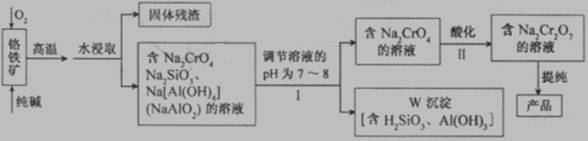
(12分) 重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等。以铬铁矿(主要成分为Cr2O3还含有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
 请回答下列问题。
请回答下列问题。
(1)若I中只用一种试剂调节溶液的pH,应选用___________(填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(2)I中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
_______________________________________________________ (用离子方程式表示)。
(3)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下: 2CrO42- (黄色)+2H+ Cr2O72- (橙红色)+H2O
Cr2O72- (橙红色)+H2O
①该反应________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式 K=__________。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液_______ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃时,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_____________________。
-
工业上可用铬铁矿(主要成分可表示为FeO·Cr 2O3,还含有Al2O3、MgCO3、SiO2 等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:
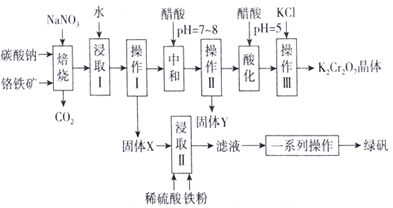
已知:Ⅰ.常见离子沉淀的pH范围
| Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- |
| 开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
| 沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+ 4CO2 ↑+7NaNO2。
(1)绿矾的化学式为________。
(2)焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为___________________________。
(3)固体Y的主要成分为________(填写化学式)。
(4)酸化过程中用醋酸调节pH=5的目的为________________________;若pH调节的过低,NO2-可被氧化为NO3-,其离子方程式为_________________________________。
(5)调节pH=5后,加入KCl 控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7________Na2Cr2O7(填“大于”或“小于”)。
(6)流程中的一系列操作为____________________________________。
-
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。 ② Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
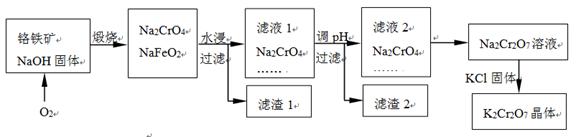 K2Cr2O7中Cr元素的化合价是________。
K2Cr2O7中Cr元素的化合价是________。
生成滤渣1中红褐色物质反应的化学方程式是________。
滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式)________。
利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是________。
由滤液2转化为Na2Cr2O7溶液应采取的措施是________。
向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、________、过滤、洗涤、干燥。
煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是________。
-
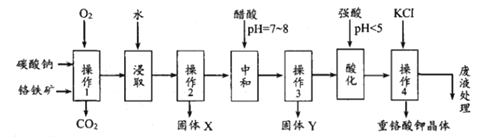
重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示为FeO.Cr2O3,还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:
请回答下列问题:
(1)操作1中发生的反应有:
4FeO·Cr2O3 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2↑
Na2CO3 + Al2O3 = 2NaAlO2 + CO2↑ Na2CO3 + SiO2 = Na2SiO3 + CO2↑
该步骤在常温下的反应速率较慢,为使反应速率增大,可采取的措施是_____________________,__________________________。(写出两条)
(2)固体Y中主要含有 ______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化为_________,请写出离子反应方程式____________。
(4)操作4中的化学反应在溶液中能发生的可能理由是_________________,获得晶体的操作依次是:加入KCl固体,在水浴上加热浓缩至____________________,冷却结晶,抽滤、洗涤、干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:
称取重铬酸钾试样1.470g,用100mL容量瓶配制成溶液。移取25.00mL溶液于碘量瓶中,加入适量稀硫酸和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L Na2S2O3标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2 + 2S2O32- = 2I- + S4O62-则所测定产品中重铬酸钾的纯度为___________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是____________。
A.粗产品若要进一步提纯,可以采用重结晶的方法
B.配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
2CrO42- + 2H+。














 请回答下列问题。
请回答下列问题。
 K2Cr2O7中Cr元素的化合价是________。
K2Cr2O7中Cr元素的化合价是________。