-
重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分Fe(CrO2)2(或写成FeO·Cr2O3),还含有Al2O3、Fe2O3、SiO2等杂质]制备,同时还可回收Cr。其主要工业流程如图所示:
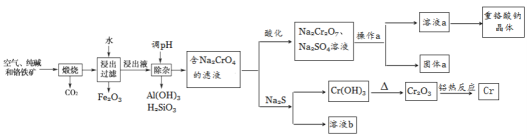
已知部分物质的溶解度曲线如图1所示。
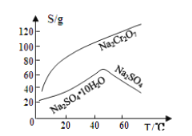
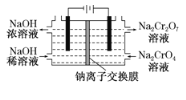
图1 图2
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为______________________________。
(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有_________(填化学式)。
(3)调节溶液的pH所选的试剂为__________________(填名称)。
(4)操作a的实验步骤为 _________________________。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,写出生成Cr(OH)3的离子方程式__________________________________。
(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。
①写出电极b的电极反应方程式:___________________________________。
②测定阳极液中Na元素和Cr元素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为____________。
(7)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________mol·L-1 ,废水处理后方能达到国家排放标准。
-
重铬酸钠是一种用途极广的强氧化剂,工业上可以用铬铁矿[主要成分为Fe(CrO2)2或FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质]制备,其主要工艺流程如图所示。请回答下列问题:
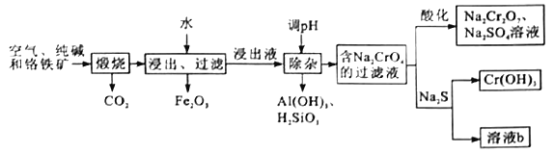
(1)煅烧铬铁矿生成Na2CrO4的化学方程式为______________________。
(2)调节溶液的pH所选的试剂为___________(填名称),写出生成Al(OH)3的化学方程式______________________。
(3)Na2CrO4溶液酸化时发生反应2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O。
Cr2O72-(橙红色)+H2O。
①该反应___________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式:K=___________。
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液___________(填标号)
A 变黄色 B 颜色不变 C 变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是___________。
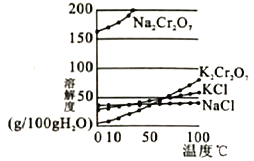
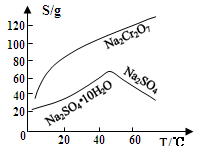
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是___________。
-
重铬酸钠是一种用途极广的强氧化剂,工业上可以用铬铁矿[主要成分为Fe(CrO2)2或FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质]制备,其主要工艺流程如图所示。请回答下列问题:
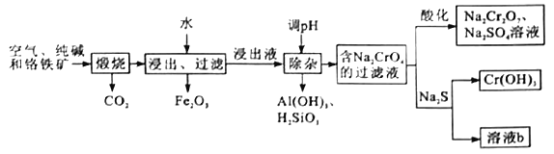
(1)煅烧铬铁矿生成Na2CrO4的化学方程式为______________________。
(2)调节溶液的pH所选的试剂为___________(填名称),写出生成Al(OH)3的化学方程式______________________。
(3)Na2CrO4溶液酸化时发生反应2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O。
Cr2O72-(橙红色)+H2O。
①该反应___________氧化还原反应(填“是”或“不是”),反应的平衡常数表达式:K=___________。
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液___________(填标号)
A 变黄色 B 颜色不变 C 变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7,的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是___________。
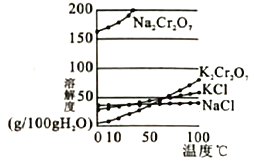
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是___________。
-
氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等。工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:

(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为______,每产生32 g Fe2O3,转移电子的数目为_______。该步骤不能使用陶瓷容器,原因是_____________________________。
8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为______,每产生32 g Fe2O3,转移电子的数目为_______。该步骤不能使用陶瓷容器,原因是_____________________________。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:___________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为__________。滤渣中除Al(OH)3外还有__________(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______%。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全。已知Cr(OH)3的溶度积常数为1.0×10-32。
-
重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,制备重铬酸钠(Na2Cr2O7)的方案1的流程图如图,铬铁矿的主要成分可表示为FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质。

除此外工厂还有相关改进工艺,制备重铬酸钠(Na2Cr2O7)的方案2如图,采用电化学原理如图所示的装置(电极为石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转化为Na2Cr2O7。
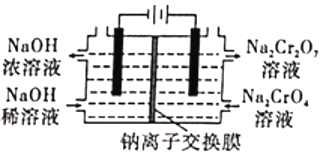
(1)在方案2中请指明哪端是阴极? ___________(填“左”或“右”)。写出阳极的电极方程式:______________________。
(2)方案1中煅烧前应将铬铁矿充分粉碎,其目的是______________________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是___________(填序号)。
a.陶瓷坩埚 b.铁坩埚 c.三脚架 d.泥三角
转窑中发生的主要反应除了下面的两个反应外,还有其他反应。
①Na2CO3+Al2O3 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
②_____FeO·Cr2O3+______Na2CO3+______O2 ______Na2CrO4+______Fe2O3+______。
______Na2CrO4+______Fe2O3+______。
请配平反应②的化学方程式。
请写出其他主要反应方程式:_________________________________。
(3)固体Y的化学式为___________、___________。
(4)向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去___________(填化学式),冷却至30-40℃得到产品晶体。洗涤该晶体的溶剂最好是___________(填序号)。
a.蒸馏水 b无水乙醇 c.75%乙醇溶液
(5)为了测定实验制得的产品中Na2Cr2O7,的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加入150mL蒸馏水并加入3mL0.5%淀粉溶液;用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL。(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-===2I-+S2O62-)
①终点实验现象是_______________________________________________________。
②该产品中Na2Cr2O7的纯度为______________________。(以质量分数表示)
③若滴定管在滴定前俯视读数,滴定结束后仰视读数,测得样品的纯度将___________(填“偏高”或“偏低”或“无影响”)
-
(1)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图。根据题意回答问题:

已知:①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2↑
8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
(2)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。酸化步骤用醋酸调节溶液pH<5,其目的是________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、_______、过滤、_______、干燥。
-
(14)铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
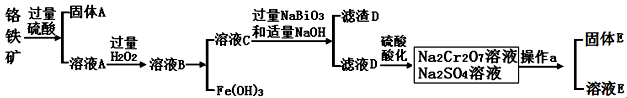
查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
②常温下,Ksp[Cr(OH)3]=6.3×10-31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝 热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,不选用盐酸的原因是 。
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全 ;
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
-
铬及其化合物在生产生活中具有十分广泛的用途。工业上以铬铁矿(主要成分是Fe(CrO2)2,Cr元素为+3价。含少量MgCO3、Al2O3、SiO2等杂质)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:
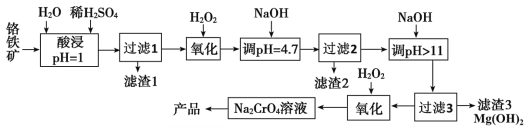
已知:+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO 形式存在且易被氧化。
形式存在且易被氧化。
(1)如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__。
(2)若省略“过滤2”步骤,产品中可能混有__(写化学式)。
(3)流程中两次使用了H2O2进行氧化,第二次氧化时反应的离子方程式为__。
(4)制取铬酸钠后的酸性废水中含有Cr2O ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O 溶液形成原电池,使Cr2O
溶液形成原电池,使Cr2O 转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__;沉降Cr3+的离子方程式为__,该反应的K=__(列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
(5)产品铬酸钠可用如图所示方法冶炼铬。

②的化学方程式为__,在实验室中引发该反应用到的两种药品是__(填化学式)。
-
以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7 是一种强氧化剂)的主要工艺流程如下:
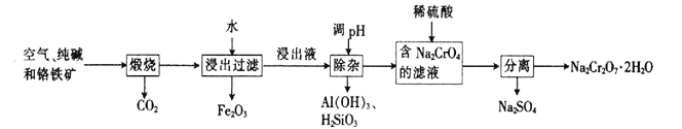
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4 时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,

①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4 转化为1mal Na2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml 溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4 溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5 min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3 位有效数字)。
-
以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7 是一种强氧化剂)的主要工艺流程如下:
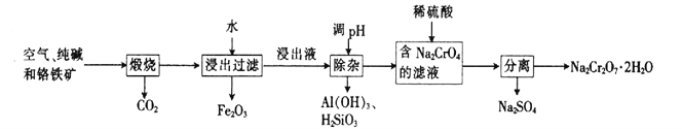
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4 时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,
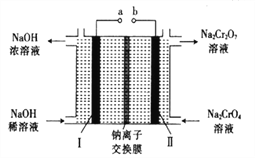
①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4 转化为1mal Na2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml 溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4 溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5 min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3 位有效数字)。



















