(1) ① 25℃时,NH4Cl溶液呈酸性,原因是______水解引起的(填“NH4+”或“Cl-”);
② 常温下,0.0100mol/L NaOH溶液的pH=___________;
③ 用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为_______(填“蓝色”或“无色”),且半分钟内颜色保持不变。
④ 已知在25℃:AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag2S(s) 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_________(填“AgCl”或“Ag2S”)。
(2)已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。
回答下列:
① 该反应的热化学方程式是______________ ;
② 该反应达到平衡后,升高温度平衡向_______ (填“正”、“逆”)反应方向移动;加入催化剂平衡________(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是___________。
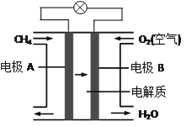
(3)燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 ________(填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:______________。
 。
。
高二化学综合题困难题