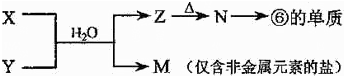
-
(14分)如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 | IA | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | |
| | | | | | | | |
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
-
(13分)下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,
回答下列问题:
|  族 族
周期 | IA | | | | | | | 0 |
| 1 | ① | ⅡA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | | ⑨ | ⑩ | |
(1) ⑩的离子结构示意图为。
(2)④⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
(3)④的氢化物沸点比⑨高,说明理由____________________________。
(4)上述元素构成的两个不同的10电子微粒,能反应生成两个相同的10电子微粒。写出二者反应的方程式为________________________。
(5)由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,立即产生红褐色沉淀,但无气体产生,该化合物的电子式________,该反应的离子方程式______________。
-
下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:
| 族 周期 周期 | | | | | | | | 0 |
| 1 | IA | ⅡA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | | | | | ③ | ④ | | |
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | | ⑨ | ⑩ | |
⑴⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
⑵比较④⑨的氢化物沸点高低顺序并说明理由____________________________。
⑶ lg单质①在常温下完全燃烧生成气态产物放出Q kJ的热量,请写出其表示燃烧的热化学方程式_________________________________________。
⑷由表中两种元素组成的电子数与⑨相同的化合物的化学式为________________。
⑸由⑦⑩两种元素组成的一种化合物,其水溶液呈_________性(填“酸”、“碱”或“中”),其原因_____________________(用离子方程式表达)。
⑹由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式__________________________________。
-
下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
| 族 周期 | IA | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
| | | | | | | | |
(1)④、⑤、⑥的原子半径由大到小的顺序为(元素符号)________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(6)若用①②组成最简单的有机物作为燃料电池的原料,请写出在碱性介质中燃料电池负极的电极反应式: 。
(7)燃煤废气中的含有氮氧化物(NOx)、二氧化碳等气体,常用下列方法对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物。
如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) , △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) , △H =-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
-
(6分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(1)④、⑤、⑥的原子半径由大到小的顺序为______。
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是______。
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
-
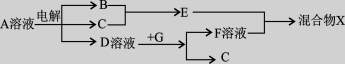
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
(1)④、⑤、⑥简单离子半径由大到小的顺序为_________________________。
(2)⑦、⑧、⑨的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)由表中①④元素的原子按1:1组成的化合物的稀溶液易被催化分解,通常使用的催化剂为(填序号)____________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)下图中 A~F是由部分上表中元素组成的单质或化合物,其中A、B、C为单质,转化关系如下:

I.若B为黄色固体,A为原子半径最小的原子组成的单质,C为双原子分子组成的单质,E能使品红溶液褪色。
①F的电子式为________。
②实验测得起始参加反应的B和最后生成的B质量相等,则起始参加反应的A和C的物质的量之比是________。
II.若D为淡黄色固体,焰色反应为黄色,组成C的元素的原子最外层电子数是内层电子数的2倍。
①下列关于D的说法正确的是________(填字母)。
a.能与水发生化合反应
b.既有氧化性,又有还原性
c.既含离子键,又含非极性共价键
d.是一种碱性氧化物
②用惰性电极将F的饱和溶液进行电解,则阳极反应式是________。
-
(12分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
| 族 周期 | IA | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | | | ② | ④ | |
| 3 | ⑤ | | ③ | | | ⑥ | ⑦ | |
(1)④、⑤、⑦的原子半径由大到小的顺序为___________。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_____________>_______。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为__________。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式____________。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
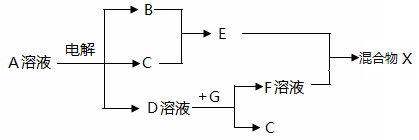
① 写出D溶液与G反应的化学方程式____________。
② 写出检验A溶液中溶质的阴离子的方法: ____________。
③ 常温下,若电解1 L 0.1 mol/L A溶液,一段时间 后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为__________ mol。
④ 若上图中各步反应均为完全转化,则混合物X中含有的物质有_______。
-
(7分)下表是元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
| 族 周期 | IA | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | | | | |
(1)①-⑧中金属性最强的元素是(元素符号)___________。
(2)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________________。
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______________。
(4)由②和④组成的化合物与⑥单质反应的化学方程式为_________________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
-
(7分)下表是元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
| 族 周期 | IA | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | | | | |
(1)①-⑧中金属性最强的元素是(元素符号)___________。
(2)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________________。
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______________。
(4)由②和④组成的化合物与⑥单质反应的化学方程式为_________________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为________ 。
-
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期 | IA | | |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(1)④、⑤、⑥的原子半径由大到小的顺序为________.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________.
(4)⑥的单质与⑤的最高价氧化物的水化物发生反应的化学方程式:________.
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:X溶液与Y溶液反应的离子方程式为________.