-
(2015秋•上海校级月考)工业制硝酸的主要反应是:
4NH3(g)+5O2(g)⇌4NO(g)+6H2O (g)+1025kJ
(1)该反应的平衡常数表达式为 ;升高温度K值 (填“增大”、“减小”或“不变”).
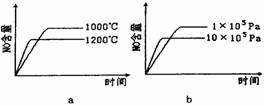
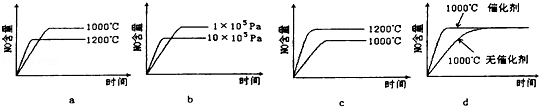
(2)若反应物起始的物质的量相同,下列关系图错误的是 (填字母序号).
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 0.975 | 0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是 .
②反应在第2min到第4min时O2的平均反应速率为 ;
③反应在第8min改变的反应条件可能是 .
-
(11分)工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
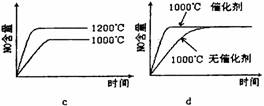
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是________
②反应在第2min到第4min时O2的平均反应速率为________ mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是________(填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是________,再次达到平衡时,NO的体积分数________(填“增大”、“减小”或“不变”)
(3)室温下,将第一次达到平衡时的混合气体通入水中,然后向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中,溶液中水的电离平衡将________(填“正向”“ 逆向”或“不”)移动,所滴加氨水的浓度为________mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
-
工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH= -1025 KJ/mol
4NO(g)+6H2O (g) ΔH= -1025 KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________

(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是________
②反应在第2min到第4min时O2的平均反应速率为________ mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是________(填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是________,再次达到平衡时,NO的体积分数________
________(填“增大”、“减小”或“不变”)
-
工业制硝酸的主要反应是:
4NH3(g)+5O2(g) 4NO(g)+6H2O (g)+Q;Q =1025 kJ·mol—1
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是____________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是___________________________________。
-
工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是_________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。
-
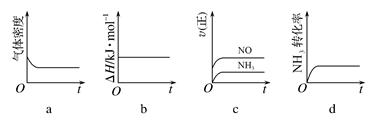
工业制硝酸的其中一步反应为氨的氧化,反应方程式为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-1025kJ/mol
氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
A.反应处于平衡状态时,c(NH3)•c(O2)=c(NO)•c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
-
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l)△H<0
②2NO(g)+O2 (g)⇌2NO2(g)△H<0
③3NO2(g)+H2O(l)⇌2HNO3(l)+NO(g)△H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是______.
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50mol NO和0.25mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%.则800℃时反应2NO+O2=2NO2的平衡常数K=______.
(3)某工厂每套设备每小时可生产20t 63%的硝酸(密度为1.4g/cm3).假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用.
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是______.
②每小时从吸收塔淋下的水的质量应是多少吨?______.

-
下图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
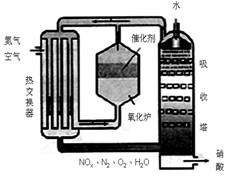
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是________。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K=________。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是________。
②每小时从吸收塔淋下的水的质量应是多少吨?
-
右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
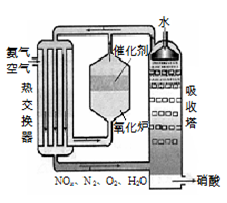
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l) △H<0
4NO(g) +6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
⑴能使吸收塔内反应速率增大,且能提高HNO3产率的措施是▲ 。
A.适当升高温度
B.适当增大吸收塔内的压强
C.增大空气中O2的浓度
D.吸收塔内填充瓷环,增大气液接触面
⑵在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K=▲ 。
⑶某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是▲ 。
②每小时从吸收塔淋下的水的质量应是多少吨?(写出计算过程)
-
工业制硝酸的主要反应是:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)+Q;Q>0
(1)该反应的平衡常数表达式为______,升高温度K值______(填“增大”、“减小”或“不变”)
(2)若反应起始的物质的量相同,下列关系图错误的是______(填序号)
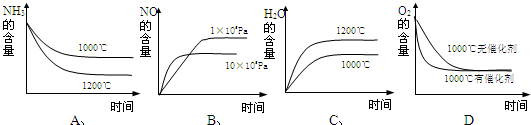
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min时,O2 的平均反应速率为______mol/(L.min)
②反应在第2min时改变了条件,改变的条件可能是______(填序号)
A、使用催化剂 B、升高温度
C、减小压强 D、增加O2 的浓度
③在第6min时,改变了反应的条件,该平衡向______移动(填“左”或“右”).
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol