-
(14分,每空2分))镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
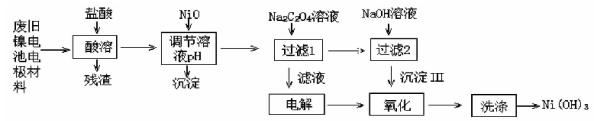
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4> NiC2O4·H2O > NiC2O4·2H2O
③Ksp[Ni(OH)2]=5.0×10-16, Ksp(NiC2O4)=5.0×10-10;
回答下列问题:
(1)酸溶后所留残渣的主要成分为 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为 (填化学式)。
(3)写出加入Na2C2O4溶液后反应的化学方程式: 。
(4)写出加入NaOH溶液所发生反应的离子方程式: 。
(5)电解过程中阴极反应式 ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式 。
(6)铁镍蓄电池,放电时总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
-
(12分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
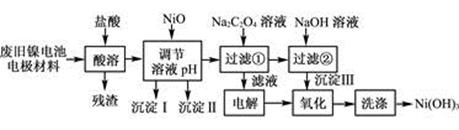
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:
________。
(3) 检验电解滤液时阳极产生的气体的方法:
________
________。
(4) 写出“氧化”反应的离子方程式:
________。
(5) 如何检验Ni(OH)3已洗涤干净?
________
________。
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
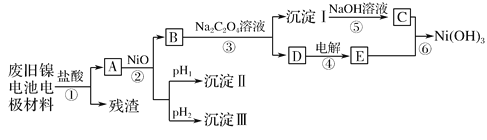
已知:a.NiCl2易溶于水,Fe3+不能氧化Ni2+。
b.某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH |
| 开始沉淀 | 沉淀完全 |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.9×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表中数据判断步骤②依次析出的沉淀Ⅱ______和沉淀Ⅲ______(填化学式),则pH1___pH2(填“>”、“=”或“<”),控制两种沉淀析出可利用______(填序号)。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则步骤③的化学方程式是______。步骤③后,过滤沉淀所需的玻璃仪器有_____________________。
(3)试写出步骤⑥的离子方程式____________________________________。
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
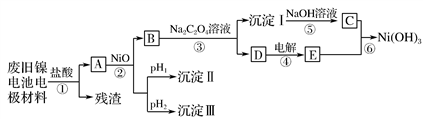
已知:a.NiCl2易溶于水,Fe3+不能氧化Ni2+。
b.某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH |
| 开始沉淀 | 沉淀完全 |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.9×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| | | |
回答下列问题:
(1)根据表中数据判断步骤②依次析出的沉淀Ⅱ________和沉淀Ⅲ________(填化学式),则pH1________pH2(填“>”、“=”或“<”),控制两种沉淀析出可利用________(填序号)。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则步骤③的化学方程式是________________________________________________。
步骤③后,过滤沉淀所需的玻璃仪器有____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______、 ____________________________。
(3)④中阳极反应产生的气体E为________,验证该气体的试剂为__________________________________________________________。
(4)试写出步骤⑥的离子方程式:______________________________。
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
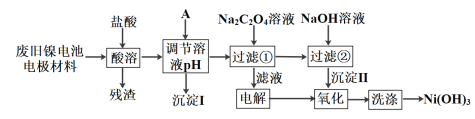
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③已知生成氢氧化物沉淀的pH如下表所示。
| 开始沉淀时 | 完全沉淀时 |
| Al(OH)3 | 3.43 | 4.19 |
| Fe(OH)3 | 2.53 | 2.94 |
| Ni(OH)2 | 7.60 | 9.75 |
回答下列问题:
(1)加入试剂A来调节溶液的pH至5左右,试剂A最好选用________。
a.NaOH b.Na2CO3 c.NiO
该过程析出沉淀的成分是____________________(填化学式)。
(2)加入Na2C2O4溶液发生反应的化学方程式是_____________________。
(3)电解时的阴极电极反应式是____________________________。检验阳极产生的气体的试剂是_____________________________ 。
(4)沉淀Ⅱ可被电解所得阳极产物氧化,该反应的离子方程式是____________。
(5)检验Ni(OH)3已洗涤干净的方法是________________________________。
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
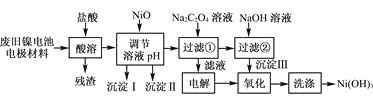
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:_____________________。
(3) 检验电解滤液时阳极产生的气体的方法:___________________________。
(4) 写出“氧化”反应的离子方程式:___________________________________。
(5) 如何检验Ni(OH)3已洗涤干净?_______________________。
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
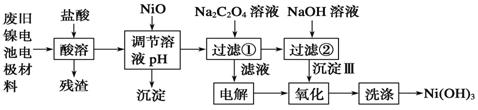
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。·H2O > NiC2O4·2H2O。
③Ksp (Ni(OH)2): 5.0×10-16 , Ksp (NiC2O4): 4.0×10-10。
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3 H2O  Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3、负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一  Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一 Ni2O3+3 H2O
Ni2O3+3 H2O
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
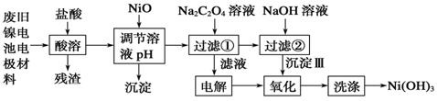
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4 >NiC2O4。 H2O > NiC2O4
H2O > NiC2O4 2H2O。
2H2O。
③ Ksp[Ni(OH)2]: 5.0×10-16 , Ksp(NiC2O4): 4.0×10-10。
认真研读题给信息,回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)电解过程中阴极反应式为: ,沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6)铁镍蓄电池,放电时总反应:Fe+Ni2O3+3H2O =Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是 。
A.电池的电解液为碱性溶液,电池的正极为Ni2O3,负极为Fe
B.电池充电时,阴极附近溶液的pH降低
C.电池放电时,负极反应为Fe+20H一一2e一
 Fe(OH)2
Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+20H一一2e一 Ni2O3+3 H2O
Ni2O3+3 H2O
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
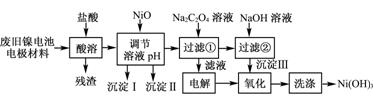
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | | |
| pH | | | |
| 开始沉淀 | 沉淀完全 | | |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式: 。
(3) 检验电解滤液时阳极产生的气体的方法: 。
(4) 写出“氧化”反应的离子方程式: 。
(5) 如何检验Ni(OH)3已洗涤干净? 。
-
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
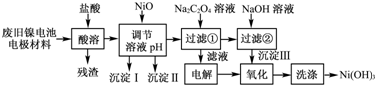
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | | |
| pH | | | |
| 开始沉淀 | 沉淀完全 | | |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
回答下列问题:
(1)用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ________(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:________.
(3)检验电解滤液时阳极产生的气体的方法:________.
(4)写出“氧化”反应的离子方程式:________.
(5)如何检验Ni(OH)3已洗涤干净?________.









