-
(12分)氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。

③上图中的B点处,NH3的平衡转化率为_______。
-
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是________。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH(填“>”、“<”或“=”)0
②在一定温度和压强下,若原料气中的NH3和CO2的物质 的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是________。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是________。

③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:

①过程Ⅱ的化学方程式是________
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式________
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH = ―1316 kJ/mol,则该燃料电池的负极反应式是________。
-
氨在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每生成2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是______.
②若起始时向容器内放入2mol N2 和6mol H2,达平衡后放出的热量为Q,则Q______(填“>”、“<”或“=”)184.4kJ.
③已知:(如图1所示)
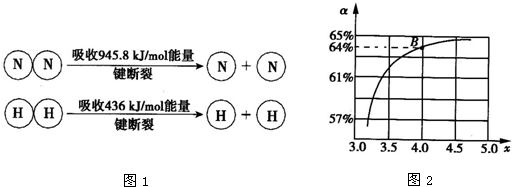
1mol N-H键断裂吸收的能量约等于______kJ.
(2)工业生产尿素的原理是以NH3 和CO2 为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H20(l),该反应的平衡常数和温度的关系如表所示:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①△H______(填“>”、“<”或“=”)0.
②在一定温度和压强下,若原料气中的NH3 和CO2 的物质的量之比(氨碳比) ,碳比(x)与CO2 平衡转化率(α)的关系如图2所示.α 随着x增大而增大的原因是______.
,碳比(x)与CO2 平衡转化率(α)的关系如图2所示.α 随着x增大而增大的原因是______.
③图2中的B点处,NH3的平衡转化率为______.
-
氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。
(1)工业合成氨的热化学方程式是_________________。
(2)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。

①由图可知:p1、p2、p3的大小关系为____________,理由是___________________。
②A、B点生成氨气的速率大小关系为____________________。B、C点,合成氨反应的化学平衡常数大小关系为__________,C点,N2的转化率为_____。③下列关于合成氨的说法正确是______(填序号)。
A.断开1个N=N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,你认为电解质溶液应显_______(填“酸性”“中性”或“碱性”),写出负极的电极反应式:_________。若电池产生的电流为1A,反应时间为1小时,氨气的转化率为80%,则最低需要______mol氨气(列出计算式即可,已知一个电子的电量是1.6×10-19C)。
-
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是________。
②若起始时向容器内放入2molN2和6molH2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1molN-H键断裂吸收的能量约等于________ kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
(3)已知:
①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g) 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
氨的催化氧化反应的热化学方程式为________
-
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q 184.8kJ(填“>”、“<”或“=”)。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
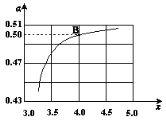
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
(3)图中的B点处,NH3的平衡转化率为 。
(4)已知: 3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→ ――③
-
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
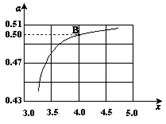
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ――③
(5)反应③中的还原剂是________,还原产物是________。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是________mol。
-
氨在国民经济中占有重要地位。
(1)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量。
① 工业合成氨的热化学方程式是________。
② 已知:
N2 (g) 2N (g)
2N (g)
H2 (g) 2H (g)
2H (g)
则断开1 mol N-H键所需的能量是_______kJ。
(2)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
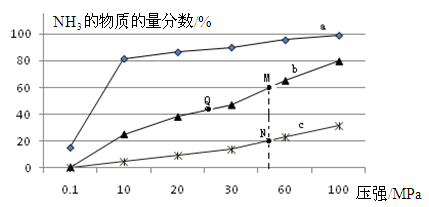
① 曲线a对应的温度是________。
② 关于工业合成氨的反应,下列叙述正确的是________(填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是________。
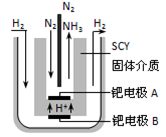 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。
则该燃料电池的负极反应式是________。
-
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
已知:1mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2kJ热量,写出反应的热化学方程式:______.
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”).
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2mol N2、8mol H2及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为______,用氮气表示的反应速率为:______.若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
______(任意写一条).
(4)在上述相同条件下,若起始时加入4mol NH3、2mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中______(填“大”、“小”或“相等”).
(5)氨被氧化生成一氧化氮的化学方程式为:______△4NO+6H2O
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是________。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是________。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=________。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部
分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式________。

CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。





 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为: