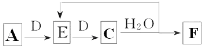-
W、X、Y、Z四种短周期元素,其原子序数依次增大,W 与X同周期且相邻,含有18电子的X与Z的氢化物可反应生成淡黄色固体,Y元素是地壳中含量最高的金属元素。下列说法正确的是
A. Y、Z元素的最高价氧化物对应的水化物可相互反应
B. 简单离子半径:r(W)<r(X)<r(Y)<r(Z)
C. W、Z的氧化物均为酸性氧化物
D. 简单氢化物的沸点:W<Z
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中X与Y同周期且相邻,Y与W均可形成18个电子的氢化物,且两者可反应生成淡黄色固体,Z是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径: r(X)<r(Y)<r(Z)<r(W)
B. 简单氢化物的沸点:Y>W
C. Y分别与Z和W形成的化合物中化学键的类型相同
D. 常温下Z的单质与X的最高价氧化物对应水化物的浓溶液不反应
-
(16分)X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_________________________________(填元素符号)。
(3)元素的非金属性Z____Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有____(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的氢化物反应的化学方程式为____________________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式_______________;B的水溶液不呈中性的原因____________________________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为_______;
(7)若使A按下列途径完全转化为F:
①F的化学式为_________;
②参加反应的A与整个过程中消耗D的物质的量之比为_________。
-
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式  B的水溶液不呈中性的原因___________________(用离子方程式表示)
B的水溶液不呈中性的原因___________________(用离子方程式表示)
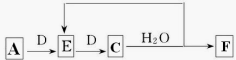
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
-
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是 (填元素符号)
(3)元素的非金属性Z Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4) X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式 ;B的水溶液不呈中性的原因 (用离子方程式表示)
(5) 液态A类似X2Z能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
(6)若使A按下列途径完全转化为F:
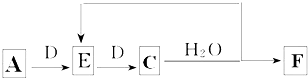
①F的化学式为 ;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为
-
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置为________________。
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是______________(填元素符号)。
(3)元素的非金属性Z________Q(填“>”或“<”)。下列各项中,不能说明这一结论的事实有________(填序号)。
A.Q的氢化物的水溶液放置在空气中会变浑浊B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态 D.Z和Q在周期表中的位置
(4)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出阳离子B的立体构型为__________,离子中键角为_________;X与Q在一定条件下可以形成极不稳定的原子个数比为1:1的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式________________。
(5)M和N均为上述五种元素中的三种组成的化合物,且M和N都为强电解质,M和N在溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:______。
-
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置为________________。
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是______________(填元素符号)。
(3)元素的非金属性Z________Q(填“>”或“<”)。下列各项中,不能说明这一结论的事实有________(填序号)。
A.Q的氢化物的水溶液放置在空气中会变浑浊B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态 D.Z和Q在周期表中的位置
(4)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式:__________;X与Q在一定条件下可以形成极不稳定的原子个数比为1:1的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式________________。
(5)M和N均为上述五种元素中的三种组成的化合物,且M和N都为强电解质,M和N在溶液反应既有沉淀出现又有气体产生,写出M和N反应的化学方程式:______。
-
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置_______________________。
(2)这五种元素原子半径从大到小的顺序为 (填元素符号)。
(3)元素的非金属性Z______Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有______(填序号)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的氢化物反应的化学方程式为__________________________________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式_______________;B的水溶液不呈中性的原因____________________________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为 。
(7)若使A按下列途径完全转化为F:
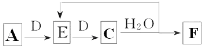
①F的化学式为_________;
②参加反应的A与整个过程中消耗D的物质的量之比为_________。
-
主族元素X、Y、Z、W、U原子序数依次增大,其中X与Y同周期且相邻,Z与U同主族且相邻,Y与W均可形成18个电子的氢化物,且两者可反应生成淡黄色固体,Z是地壳中含量最高的金属元素。下列说法正确的是( )
A.据组成元素推测,X与Z形成的化合物既能溶于强酸又能溶于强碱
B.若Z原子核内含有a个质子,则U原子核内含有a+8个质子
C.Y分别与Z和W形成的化合物中化学键的类型相同
D.对应简单离子半径:r(Y)<r(X)<r(Z)<r(W)
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W是地壳中含量最多的元素,W和Z位于同一主族,X的焰色反应为黄色,Y的最外层电子数比Z的最外层电子数少1,下列说法正确的是
A.W、Z具有相同的最高正价
B.X、Z形成的化合物水溶液呈碱性
C.Y的最简单氢化物的热稳定性比Z的强
D.原子半径:Z>Y> X> W