-
(10分)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是_____________。
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
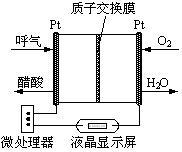
(2)乙醇燃料电池具有很高的实用价值。下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。则该电池的负极反应式为________。
(3)已知:CO(g)+1/2 O2(g)=CO2(g);△H2=-283 kJ·mol-1
H2(g)+1/2 O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为
________
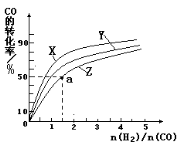
(4)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系。请回答:
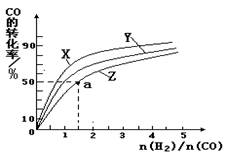
①在上述三种温度中,曲线Z对应是________。
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g) 的平衡常数K =________。
CH3OH(g) 的平衡常数K =________。
-
(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) 2H2(g)
2H2(g) CH3OH(g)
CH3OH(g) Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)判断反应达到平衡状态的依据是( )
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q________0 (填“>”、“ ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是( )
A.加入催化剂 B.充入CO C.充入H2 D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v ________mol /(L·min),
________mol /(L·min),
CO的转化率为________。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s) CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
C(s) H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) 平衡常数K2
H2(g) 平衡常数K2
CO(g) H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) 平衡常数K3
CO2(g) 平衡常数K3
则K1、K2 、K3之间的关系是:________。
-
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,且CH3OH(g)+3/2O2(g)  CO2(g)+2H2O(l) △H=-761kJ/mol;则CO(g)+ 2H2(g)
CO2(g)+2H2O(l) △H=-761kJ/mol;则CO(g)+ 2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是 。
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是 。
A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
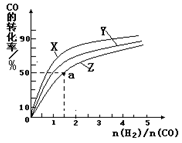
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
①在上述三种温度中,曲线X对应的温度是 。
②利用图中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+ 2H2(g)  CH3OH(g) 的平衡常数K = 。
CH3OH(g) 的平衡常数K = 。
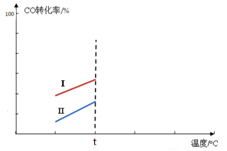
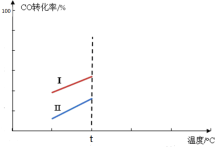
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况。请在右图中补充t℃后的变化情况。
-
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g) △H
CH3OH(g) △H
(1)已知CO(g)、H2(g)的标准燃烧热分别为-285.8kJ•mol-1,-283.0kJ•mol-1,
且CH3OH(g)+3/2O2(g)  CO2(g)+2H2O(l) △H=-761kJ/mol;
CO2(g)+2H2O(l) △H=-761kJ/mol;
则CO(g)+ 2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是 。
A.容器内气体密度保持不变 B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等 D.CO的体积分数保持不变
(3)下列措施中既有利于增大该反应的反应速率又能增大CO转化率的是 。
A.将CH3OH及时从混合物中分离
B.降低反应温度
C.恒容装置中充入H2
D.使用高效催化剂
(4)在容积为2L的恒容容器中,分别研究反应在300℃、350℃和400℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
①在上述三种温度中,曲线X对应的温度是
②利用图中a点对应的数据,计算出曲线Z在对应温度下
CO(g)+ 2H2(g)  CH3OH(g) 的平衡常数K = 。
CH3OH(g) 的平衡常数K = 。
(5)其他条件相同时,某同学研究该甲醇合成反应在不同催化剂Ⅰ或Ⅱ作用下反应相同时间时,CO的转化率随反应温度的变化情况。请在右图中补充t℃后的变化情况。
-
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH________0 (填“>”、“=”或“<”);
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)= 0.2 mol/L,此时的温度为________。
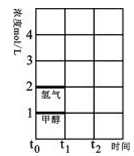
(2)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇)。
(3)300℃、1.01×105Pa下,上述反应的ΔH数值为90.8 kJ/mol。在该温度下,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应放出或吸收的能量 | x kJ | y kJ | z kJ |
| 反应物转化率 | Ф1 | Ф2 | Ф3 |
请比较以下每组数据的大小(填“>”、“<”或“=”):
①2c1________c3 ② x+y 90.8 ③Ф1+Ф3________1

-
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1
(1)下列措施中有利于增大该反应的反应速率的是______.
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g)△H2=-283kJ•mol-1
O2(g)═CO2(g)△H2=-283kJ•mol-1
H2(g)+ O2(g)═H2O(g)△H3=-242kJ•mol-1
O2(g)═H2O(g)△H3=-242kJ•mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:______.
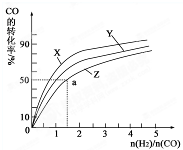
(3)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线Z对应的温度是______.
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)⇌CH3OH(g) 的平衡常数K=______.
-
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
(1)该反应的ΔH___0(填“>”、“<”或“=”)。
(2)若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行上述反应,下列事实能说明此反应已达到平衡状态的是___。
A.容器内气体密度保持不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与生成H2的速率相等
D.CO的体积分数保持不变
(3)当按投料比 =2,分别在P1、P2、P3压强下,测得不同温度下平衡时CO的平衡转化率如图1。
=2,分别在P1、P2、P3压强下,测得不同温度下平衡时CO的平衡转化率如图1。
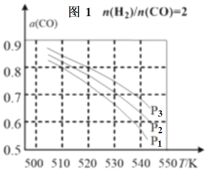
520K时,投料比 =2(总物质的量为3mol),维持反应过程中压强P3不变,达到平衡时测得容器体积为0.1L,则平衡常数K=___。
=2(总物质的量为3mol),维持反应过程中压强P3不变,达到平衡时测得容器体积为0.1L,则平衡常数K=___。
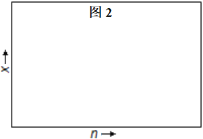
若H2和CO的物质的量之比为n∶1(维持反应过程中压强P3不变),相应平衡体系中CH3OH的物质的量分数为x,请在图2中绘制x随n变化的示意图___。
(4)甲醇合成甲醚的反应为:
Ⅰ.2CH3OH(g) CH3OCH3(g)+H2O(g)(主反应)
CH3OCH3(g)+H2O(g)(主反应)
Ⅱ.2CH3OH(g) C2H4(g)+2H2O(g)(副反应)
C2H4(g)+2H2O(g)(副反应)
反应过程中的能量变化如图3所示。
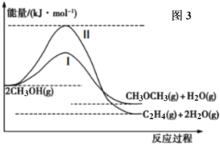
①在一定温度下,在恒容容器中进行合成甲醚的反应,测得CH3OCH3含量随着时间的推移,先增大后减小,请结合碰撞理论说明原因:___。
②在不改变温度的前提下,说出其中一个能增大CH3OCH3选择性的措施:___。
-
甲醇是一种可再生能源,具有开发和应用的广阔前景。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列有关上述反应的说法正确的是________。
a.恒温、恒容条件下,容器内的压强不发生变化则可逆反应达到平衡
b.一定条件下,H2的消耗速率是CO的消耗速率的2倍时可逆反应达到平衡
c.保持容器体积不变,升高温度可提高CO的转化率
d.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产量
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
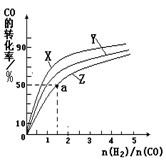
①在上述三种温度中,曲线Z对应的温度是________。
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K (写出计算过程)。
③在答题卡相应位置上画出:上述反应达到平衡后,减小体系压强至达到新的平衡过程中,正逆反应速率与时间的变化关系图并标注。

(3)已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为________。
-
(12分) 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示: 由表中数据判断 ΔH1________0 (填“>”、“=”或“<”)。

③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为________
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
(3)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
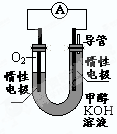
①该电池正极的电极反应为____________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为____________.
-
(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①反应Ⅱ的平衡常数表达式是。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1________0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为________。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -566.0 kJ/mol
③H2O(g) = H2O(l) ΔH3 = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。该电池正极的电极反应为________。

CH3OH(g) △H
CO2(g)+2H2O(l) △H=-761kJ/mol;则CO(g)+ 2H2(g)
CH3OH(g)的△H= 。


CH3OH(g) 的平衡常数K = 。













