-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种.
方法Ⅰ:次氯酸盐氧化法,工艺流程如图.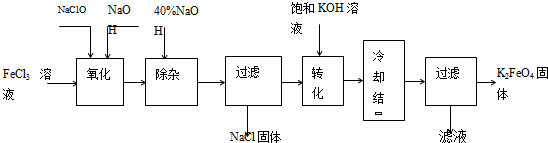
(1)完成“氧化”过程中反应的化学方程式:
______FeCl3+______NaOH+______NaClO→______ Na2FeO4+______d+______d其中氧化剂是______(填化学式).
(2)“转化”过程中发生反应的化学方程式为______.
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用______溶解,然后______.
方法Ⅱ:电解法.以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH.
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为______.
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图

(1)“氧化”过程中的氧化剂是________(填化学式)。比较NaClO、Na2FeO4的氧化性强弱(填<、=、>)________。
“除杂”除去的是________。
(2)“转化”过程中发生的化学反应方程式为________,与我们见过的分离混合物的原理相似。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用 溶解,然后。
方法Ⅱ:电解法。
(4)以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入 。
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图所示。

(1)完成“氧化”过程中反应的化学方程式:______FeCl3+______NaOH+______NaClO==______Na2FeO4+______ +______
+______ 。____________其中氧化剂是________(填化学式)。
。____________其中氧化剂是________(填化学式)。
(2)“转化”过程中发生反应的化学方程式为____________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为________________________________。
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。

(1)已知“氧化”过程中氧化产物为Na2FeO4,写出其反应的化学方程式:
(2)“转化”过程中发生反应的化学方程式为 。
(3)上述工艺得到的高铁酸钾常含有杂质,可将粗产品用稀KOH溶液溶解,然后加入饱和KOH溶液,冷却结晶,这种分离提纯的方法为 法。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定,工业上制备K2FeO4的常用方法有两种。方法I:次氯酸盐氧化法。工艺流程如图所示。

(1)完成“氧化”过程中反应的化学方程式:_______,其中氧化剂是______ (填化学式)。
(2)“转化”过程中发生反应的化学方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,该反应能进行的原因是____________。
(3)“氧化”过程中用到的NaClO的水溶液呈______ 性(填“酸”或“城”)。 0.1mol/L的NaClO水溶液中,离子浓度大小关系为_____________。
方法II:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH生成K2FeO4。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为_________。
(5)K2FeO4也可以组成碱性电池,该电池总反应的离子方程式为:2FeO42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)2+4OH-,产生OH-的电极为_______极。
(6)K2FeO4作为新型净水剂的原因是____________。
-
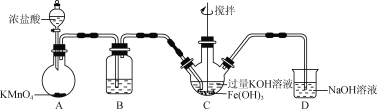
高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
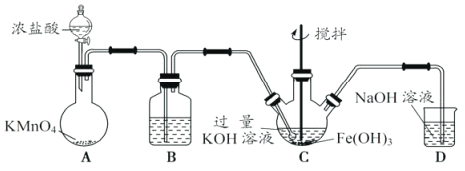
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
-
高铁酸钾(K2FeO4)是很好的净水剂,高铁酸钡( BaFeO4)是高能电池阳极的优良材料。已知:K2FeO4为紫色固体,微溶于KOH溶液,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定;在碱性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4难溶于水和碱性溶液。某化学兴趣小组欲制取“84”消毒液,进而制取少量K2FeO4和 BaFeO4。请回答下列问题:
(实验一)选择合适的仪器和试剂制取氯气,进而制备高浓度的“84”消毒液。

(1)选择合适的仪器,导管接口正确的连接顺序为___________;所选装置(A或B)中发生反应的离子方程式为______________________。
(实验二)用“84”消毒液制取K2FcO4
实验步骤:①用如图所示装置(夹持仪器略去)使反应物充分反应;②用砂芯漏斗对烧杯中的溶液进行抽滤,向滤液中慢慢加入KOH溶液;③再用砂芯漏斗对步骤②的最后反应混合物进行抽滤,并用苯、乙醚洗涤沉淀,真空干燥后得K2FeO4。
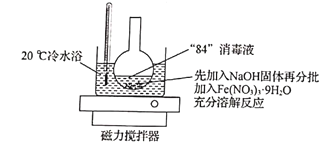
(2)写出步骤①中物质在20℃冷水浴中发生反应的化学方程式:______________________。
(3)步骤②中能够发生反应的原因是______________________,步骤③中不用水,而用苯、乙醚洗涤沉淀的目的是_________________________________。
(实验三)将上述产品配成K2FeO4碱性溶液,再慢慢加入Ba(OH)2溶液,抽滤得 BaFeO4。
(4)若投入ag硝酸铁晶体,得到bg高铁酸钡,则高铁酸钡的产率是___________。[已知Fe(NO3)3·9H2O的摩尔质量为404g·mol-1, BaFeO4的摩尔质量为257g·mol-1]
(实验四)利用如图所示电解装置也可以制得 BaFeO4。

(5)在___________(填“阳极区”或“阴极区”)可得到高铁酸钡,阳极的电极反应式为____________。
-
高铁酸钾(K2FeO4)是很好的净水剂,高铁酸钡( BaFeO4)是高能电池阳极的优良材料。已知:K2FeO4为紫色固体,微溶于KOH溶液,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定;在碱性溶液中,NaCl、NaNO3、K2FeO4的溶解性都小于Na2FeO4;BaFeO4难溶于水和碱性溶液。某化学兴趣小组欲制取“84”消毒液,进而制取少量K2FeO4和 BaFeO4。请回答下列问题:
(实验一)选择合适的仪器和试剂制取氯气,进而制备高浓度的“84”消毒液。

(1)选择合适的仪器,导管接口正确的连接顺序为___________;所选装置(A或B)中发生反应的离子方程式为______________________。
(实验二)用“84”消毒液制取K2FcO4
实验步骤:①用如图所示装置(夹持仪器略去)使反应物充分反应;②用砂芯漏斗对烧杯中的溶液进行抽滤,向滤液中慢慢加入KOH溶液;③再用砂芯漏斗对步骤②的最后反应混合物进行抽滤,并用苯、乙醚洗涤沉淀,真空干燥后得K2FeO4。
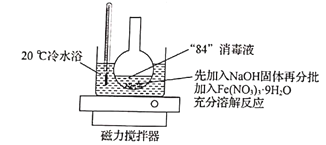
(2)写出步骤①中物质在20℃冷水浴中发生反应的化学方程式:______________________。
(3)步骤②中能够发生反应的原因是______________________,步骤③中不用水,而用苯、乙醚洗涤沉淀的目的是_________________________________。
(实验三)将上述产品配成K2FeO4碱性溶液,再慢慢加入Ba(OH)2溶液,抽滤得 BaFeO4。
(4)若投入ag硝酸铁晶体,得到bg高铁酸钡,则高铁酸钡的产率是___________。[已知Fe(NO3)3·9H2O的摩尔质量为404g·mol-1, BaFeO4的摩尔质量为257g·mol-1]
(实验四)利用如图所示电解装置也可以制得 BaFeO4。

(5)在___________(填“阳极区”或“阴极区”)可得到高铁酸钡,阳极的电极反应式为____________。
-
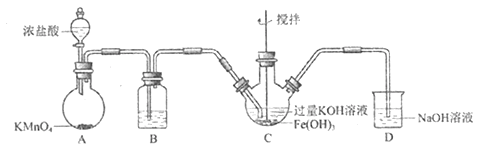
高铁酸钾(K2FeO4)为高效净水剂,紫色固体,易溶于水,微溶于KOH溶液;具有强氧化性,在酸性溶液中完全、快速产生O2,在碱性溶液中较稳定。某实验小组制备高铁酸钾并探究其性质。
(1)制备K2FeO4(夹持装置略)
①装置B中所用试剂为____。
②C中得到紫色固体和溶液,C中发生的主要反应为________(用化学方程式表示)。
(2) 探究K2FeO4的性质
①将K2FeO4溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明酸性条件下 与
与 氧化性的强弱关系,请说明理由:____。
氧化性的强弱关系,请说明理由:____。
②取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,某同学设计了以下方案:取少量a,滴加KSCN溶液至过量,溶液呈红色。该方案并不完善,因为溶液变红的原因可能是____,___(用离子方程式表示),重新设计实验方案,证明是K2FeO4氧化了Cl-而产生Cl2:将装置C中混合物过滤,___。[实验中必须使用的试剂:盐酸、KOH溶液、淀粉碘化钾试纸]
-
实验小组制备高铁酸钾(K2FeO4) 并探究其性质。资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制备K2FeO4 (夹持装置略)
(1)简述检验该装置气密性的方法:________________________________________。
(2)A为氯气发生装置。A中化学反应的被还原的元素是____________________________。
(3)装置B的作用是除杂,所用试剂为_____________________________________。
(4)C中得到紫色固体和溶液。请写出C中发生的化学反应并标出电子转移的方向和数目:_________。 此反应表明:氧化性Cl2______FeO42-(填“>”或“<”)。
(5) C中除了发生③中的反应,还发生化学反应的离子方程式是:______________________。
(6)用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。此实验得出Cl2和FeO42-的氧化性强弱关系与制备实验时得出的结论相反,原因是__________________________。













